Слайд 2
Почему протекают химические реакции
На бумаге можно написать уравнение
любой химической реакции («бумага все стерпит»), а возможна ли
такая реакция практически?
В одних случаях (например, при обжиге известняка:
СаСО3—> СаО + СО2) достаточно повысить температуру, чтобы реакция началась, а в других (например, восстановление кальция из его оксида водородом:
СаО + Н2 —>Са + Н2О) реакцию невозможно осуществить ни при каких условиях!
Слайд 3
Термодинамика - наука о взаимных превращениях различных видов
энергии.
Первый закон термодинамики — закон сохранения энергии: энергия
не возникает из ничего и не исчезает бесследно, а только переходит из одной формы в другую.
Слайд 5
Известно, что при химических реакциях происходят глубокие качественные
изменения в системе, рвутся связи в исходных веществах и
возникают новые связи в конечных продукт; при этом изменяется электронное состояние атомов, их взаимоположение, а потому и внутренняя энергия продуктов реакции отличается от внутренней энергии реагентов.
2Н2(г) + О2 = 2Н2О(ж) + 285,84 кДж
Слайд 6
Тепловой эффект
химических реакций
Слайд 7
Рассмотрим два возможных случая:
1. E реагентов > E
продуктов. Исходя из закона сохранения энергии, в результате такой
реакции энергия должна выделяться в окружающую среду: нагревается воздух, пробирка, автомобильный двигатель, продукты реакции.
Реакции, при которых выделяется энергия и нагревается окружающая среда, называют экзотермическими.
Слайд 8
2. Е реагентов < Е продуктов. Исходя из
закона сохранения энергии, следует предположить, что исходные вещества при
таких процессах должны поглощать энергию из окружающей среды, температура реагирующей системы должна понижаться.
Реакции, при протекании которых энергия поглощается из окружающей среды, называют эндотермическими.
Слайд 9
Энергия, которая выделяется или поглощается в химической реакции,
называется, тепловым эффектом этой реакции.
Этот термин используют повсеместно,
хотя точнее было бы говорить об энергетическом эффекте реакции.
Тепловой эффект реакции выражается в единицах энергии. Энергия отдельных атомов и молекул — величина незначительная. Поэтому тепловые эффекты реакций относят обычно к тем количествам веществ, которые определены уравнением, и выражают в Дж или кДж.
Слайд 10
Уравнение химической реакции, в котором указан тепловой эффект,
называется термохимическим уравнением.
Например, термохимическое уравнение:
2Н2 + О2 = 2Н2О + 484 кДж
Слайд 11
Знание тепловых эффектов химических реакций имеет большое практическое
значение. Например, при проектировании химического реактора важно предусмотреть или
приток энергии для поддержания реакции путем подогрева реактора, или, наоборот, отвод избытка теплоты, чтобы не было перегрева реактора со всеми вытекающими отсюда последствиями, вплоть до взрыва.
Слайд 12
Расчёт теплового эффекта реакции
Если реакция проходит между
несложными молекулами, то подсчитать тепловой эффект реакции достаточно просто.
Например:
Н2 + CI2 —> 2НCI
Энергия затрачивается на разрыв двух химических связей
Н—Н и CI—CI, энергия выделяется при образовании двух химических связей Н—CI. Именно в химических связях сосредоточена важнейшая составляющая внутренней энергии соединения. Зная энергии этих связей, можно по разности узнать тепловой эффект реакции.
EH-H = 436 кДж/моль, ЕCI-CI = 240 кДж/моль,
EHCI = 430 кДж/моль,
Qp= 2 • 430 - 1 • 436 - 1 • 240 = 184 кДж.
Следовательно, данная реакция — экзотермическая.
Слайд 13
А как, например, рассчитать тепловой эффект реакции разложения
карбоната кальция? Ведь это соединение немолекулярного строения. Как точно
определить, какие именно связи и сколько их разрушается, какова их энергия, какие связи и сколько их образуется в оксиде кальция?
Для расчета тепловых эффектов реакций используют значения величин теплот образования всех участвующих в реакции химических соединений (исходных и продуктов).
Теплота образования соединения (Qобр) — это тепловой эффект реакции образования одного моля соединения из простых веществ, устойчивых в стандартных условиях
(25 °С, 1 атм.).
При этих условиях теплота образования простых веществ равна нулю по определению.
Слайд 14
Например, сжигая уголь в кислороде, нельзя определить Qобр
угарного газа СО, так как всегда идет и процесс
полного окисления. В этом случае на помощь приходит закон, сформулированный в прошлом веке петербургским академиком Г. И. Гессом.
Тепловой эффект химической реакции не зависит от промежуточных стадий (при условии, что исходные вещества и продукты реакции одинаковы).
С + О2 = СО2 + 394 кДж (Q1)
C + 0,5О2 = CO +? кДж (Q2)
CО + 0,5О2 = CО2 +284 кДж (Q3)
___________________________________________________________________________
Q1= Q2 + Q3 Q2= Q1 - Q3 = 394-284 = 110 кДж
Слайд 15
Тепловой эффект химической реакции равен сумме теплот образования
всех продуктов реакции минус сумма теплот образования всех реагентов
(с учетом коэффициентов в уравнении реакции).
Qр = ∑Qобр (продукты) - ∑Qобр (реагенты)
Например:
Fe2О3 + 2AI = 2Fe + AI2О3
Qобр (AI2О3) = 1670 кДж/ моль
Qобр (Fe2О3) = 820 кДж/ моль
Qобр (AI) = 0
Qобр (Fe) = 0
_________________________________________________________________________________
Qр = Qобр (AI2О3) - Qобр (Fe2О3) = 1670-820= 850 кДж
Слайд 16
Если данное химическое соединение можно непосредственно получить из
простых веществ, причем реакция идет количественно (100% -ный выход
продуктов), достаточно провести реакцию и измерить ее тепловой эффект с помощью специального прибора — калориметра. Так определяют теплоты образования многих оксидов, хлоридов, сульфидов и т. п.
Слайд 17
Экзо- и эндотермические процессы в живых организмах
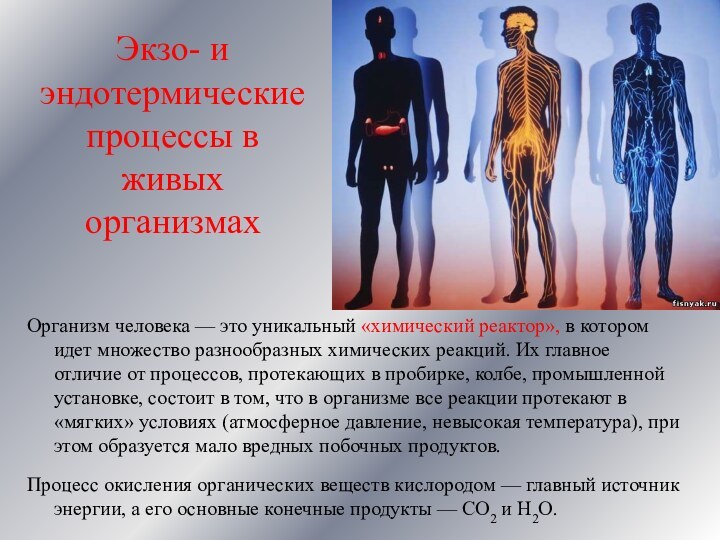
Организм человека
— это уникальный «химический реактор», в котором идет множество
разнообразных химических реакций. Их главное отличие от процессов, протекающих в пробирке, колбе, промышленной установке, состоит в том, что в организме все реакции протекают в «мягких» условиях (атмосферное давление, невысокая температура), при этом образуется мало вредных побочных продуктов.
Процесс окисления органических веществ кислородом — главный источник энергии, а его основные конечные продукты — СО2 и Н2О.
Слайд 18
Эта выделившаяся энергия представляет собой
большую величину, и если бы пища окислялась в организме
быстро и полностью, то уже несколько съеденных кусочков сахара вызвали бы перегревание организма. Но биохимические процессы, суммарный тепловой эффект которых по закону Гесса не зависит от механизма и является постоянной величиной, идут ступенчато, как бы растянуты во времени. Поэтому организм не «сгорает», а экономно расходует эту энергию на процессы жизнедеятельности. Но всегда ли происходит так?
Слайд 19
Каждый человек должен хотя бы приблизительно представлять, сколько
энергии поступает в его организм с пищей и сколько
расходуется в течение суток.
Одна из основ рационального питания такова: количество поступающей с пищей энергии не должно превышать расход энергии (или быть меньше) более чем на 5%, иначе нарушается обмен веществ, человек полнеет или худеет.
Энергетический эквивалент пищи — ее калорийность, выражаемая в килокалориях на 100 г продукта (часто указывают на упаковке, можно также найти в специальных справочниках и книгах по кулинарии). А расход энергии в организме зависит от возраста, пола, интенсивности труда. Например, женщине (секретарь, бухгалтер) требуется в сутки около 2100 ккал, а мужчине (лесоруб, бетонщик, шахтер) ежесуточно необходимы приблизительно 4300 ккал.
Слайд 20
Наиболее полезно питание с невысокой калорийностью, но с
наличием всех компонентов в пище (белков, жиров, углеводов, минеральных
веществ, витаминов, микроэлементов).
Слайд 21
Энтропия
Энергетическая ценность продуктов питания и теплотворная способность топлива
связаны с экзотермическими реакциями их окисления. Движущей силой таких
реакций является «стремление» системы к состоянию с наименьшей внутренней энергией.
Экзотермические реакции начинаются самопроизвольно, или требуется только небольшой «толчок» — первоначальная подача энергии.
А что же тогда является движущей силой эндотермических реакций, в ходе которых тепловая энергия поступает из окружающей среды и запасается в продуктах реакции, превращаясь в их внутреннюю энергию? Эта «сила» связана со стремлением любой системы к наиболее вероятному состоянию, которое характеризуется максимальным беспорядком, ее называют энтропией.
Например, молекулы, входящие в состав воздуха, не падают на Землю, хотя минимуму потенциальной энергии каждой молекулы соответствует наиболее низкое ее положение, так как стремление к наиболее вероятному состоянию заставляет молекулы беспорядочно распределяться в пространстве.
Слайд 22
Представьте, что вы в стакан насыпали разные орехи.
Практически невозможно добиться при встряхивании их расслоения, упорядоченности, так
как и в этом случае система будет стремиться к наиболее вероятному состоянию, при котором беспорядок в системе возрастает, поэтому орехи всегда будут перемешаны. Причем чем больше частиц мы имеем, тем вероятность беспорядка больше.
Самый большой порядок в химических системах — в идеальном кристалле при температуре абсолютного нуля. Говорят, что энтропия в данном случае равна нулю. С повышением температуры в кристалле начинают усиливаться беспорядочные колебания атомов (молекул, ионов). Энтропия увеличивается. Особенно резко это происходит в момент плавления при переходе от твердого тела к жидкости и еще в большей степени — в момент испарения при переходе от жидкости к газу.
Слайд 23
Энтропия газов значительно превышает энтропию жидких и тем
более твердых тел. Если вы прольете немного бензина в
закрытом помещении, например в гараже, то скоро почувствуете его запах во всем объеме помещения. Происходит испарение (эндотермический процесс) и диффузия, беспорядочное распределение паров бензина по всему объему. Пары бензина имеют большую энтропию по сравнению с жидкостью.
Процесс кипения воды с энергетической точки зрения тоже эндотермический процесс, но выгоден с точки зрения увеличения энтропии при переходе жидкости в пар. При температуре 100 °С энтропийный фактор «перетягивает» энергетический — вода начинает кипеть — пары воды имеют большую энтропию по сравнению с жидкой водой.
Слайд 24
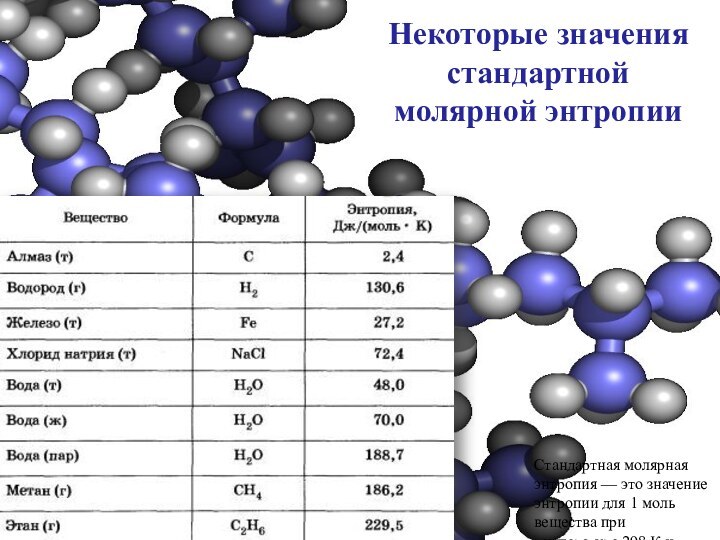
Некоторые значения стандартной молярной энтропии
Стандартная молярная энтропия —
это значение энтропии для 1 моль вещества при температуре
298 К и давлении 105 Па.
Слайд 25
Анализируя данные, приведенные в таблице, обратите внимание, насколько
мало значение энтропии для алмаза, имеющего очень правильную структуру.
Вещества, образованные более сложными частицами, обладают очень большими значениями энтропии. Например, энтропия этана больше энтропии метана.
Эндотермические реакции — это как раз те реакции, в которых наблюдается достаточно сильный рост энтропии, например, за счет образования газообразных продуктов из жидких или твердых веществ или же за счет увеличения числа частиц.
Например:
СаСО2 —> СаО + СО2 – Q
2NH3 —> N2 + 3H2 – Q
Слайд 26
Выводы:
1. Направление химической реакции определяется двумя факторами:
стремлением к уменьшению внутренней энергии с выделением энергии и
стремлением к максимальному беспорядку, то есть к увеличению энтропии.
2. Эндотермическую реакцию можно заставить идти, если она сопровождается увеличением энтропии.
3. Энтропия увеличивается при повышении температуры и особенно сильно при фазовых переходах: твердое — жидкое, твердое — газообразное.
4. Чем выше температура, при которой проводят реакцию, тем большее значение будет иметь энтропийный фактор по сравнению с энергетическим.
Слайд 27
Существуют экспериментальные и теоретические методы определения знтропий различных
химических соединений. Используя эти методы, можно количественно рассчитать изменения
энтропии при протекании конкретной реакции аналогично тому, как это делается для теплового эффекта реакции. В результате появляется возможность предсказать направление химической реакции.
Возможность протекания химических реакций в
зависимости от изменения энергии и энтропии
Составлены специальные справочные данные, которые включают сравнительную характеристику этих величин с учетом температуры.