степени окисления.
Mn
Природные соединения
Свойства простых веществ.
Соединения Mn
Соединения Mn
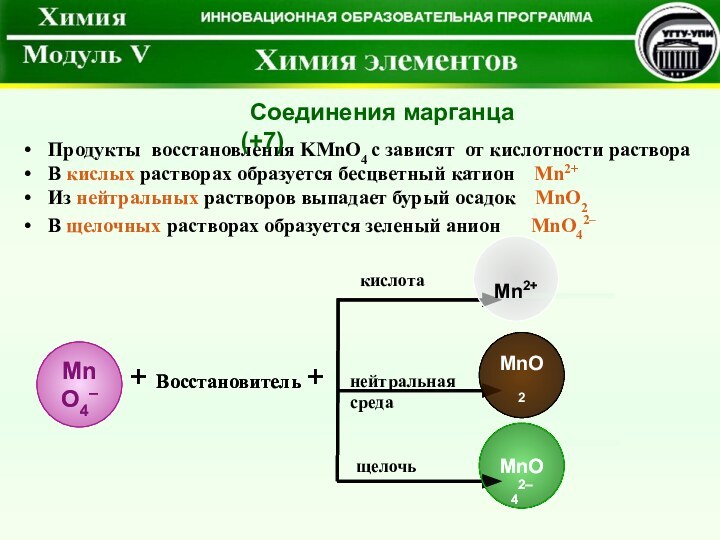
(+7). Окислительные свойства.Соединения Mn (+6). Окислительные свойства.
Оксид MnO2.
Оксид, гидроксид и соли Mn (+2).
Tc и Re.
Свойства металлов.
Соединения Tc и Re в степени окисления (+7).
Основные вопросы, рассматриваемые в лекции
Металлы VIIБ-подгруппы