- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Аммиак
Содержание
- 2. Встречаемся с аммиаком производство HNO3МедицинаПродукт белкового
- 3. История открытия аммиака Посредине ливийской пустыни стоял
- 4. Получение аммиака (NH3)
- 5. Физические свойства аммиака NH3 NH3 аммиак -
- 6. Строение молекулы аммиака▪▪▪Н * **НН│ N▪▪Атом азота
- 7. Химические свойства аммиакаРеакции, идущие сизменением степени окисления
- 8. Скачать презентацию
- 9. Похожие презентации






Слайд 2
Встречаемся с аммиаком
производство HNO3
Медицина
Продукт белкового обмена в живых
организмах
исключительной важности сырье для производства азотсодержащих веществ, применяемых в сельском хозяйстве, химии, медицине, военном деле. И что не менее важно, он является одним из продуктов белкового обмена в организме.
Слайд 3
История открытия аммиака
Посредине ливийской пустыни стоял храм,
посвященный богу Амон Ра. В древности арабские алхимики получали
из оазиса Амон, находившегося около храма, бесцветные кристаллы. растирали в ступках, нагревали – и получали едкий газ. Сначала его именовали аммониак, а потом сократили название до «аммиак».В 18 веке аммиак был получен английским химиком Джозефом Пристли.
Сегодня аммиак — исключительной важности сырье для производства азотсодержащих веществ, применяемых в сельском хозяйстве, химии, медицине, военном деле. И что не менее важно, он является одним из продуктов белкового обмена в организме.
Слайд 5
Физические свойства аммиака NH3
NH3 аммиак - газ:
без цвета, с характерным запахом,
легче
воздуха (собирают в перевёрнутый вверх дном сосуд)NH3 - ЯДОВИТ!
Жидкий аммиак вызывает сильные ожоги кожи; обычно его перевозят в стальных баллонах (окрашены в желтый цвет, имеют надпись "Аммиак" черного цвета)
Нашатырный спирт – 3-10 % раствор аммиака
Аммиачная вода - 18 -25 % раствор аммиака
Смесь аммиака с воздухом взрывоопасна!
Слайд 6
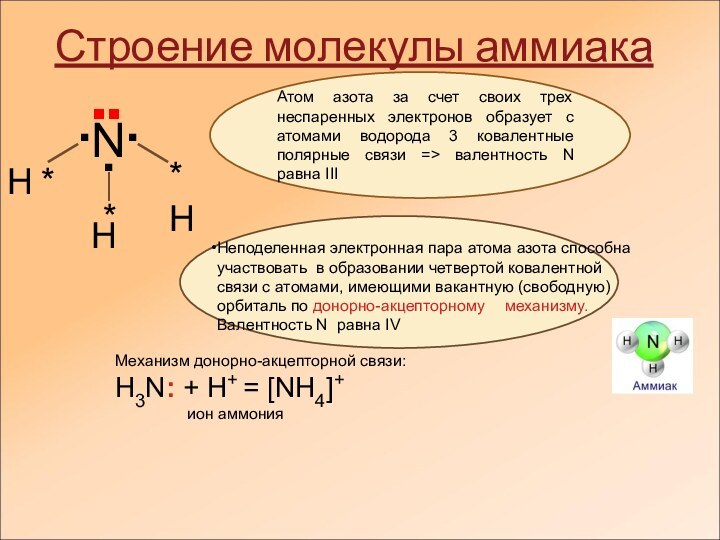
Строение молекулы аммиака
▪
▪
▪
Н *
*
*Н
Н
│
N
▪▪
Атом азота за
счет своих трех неспаренных электронов образует с атомами водорода
3 ковалентные полярные связи => валентность N равна ІІІНеподеленная электронная пара атома азота способна участвовать в образовании четвертой ковалентной связи с атомами, имеющими вакантную (свободную) орбиталь по донорно-акцепторному механизму. Валентность N равна ІV
Механизм донорно-акцепторной связи:
H3N: + H+ = [NH4]+
ион аммония
Слайд 7
Химические свойства аммиака
Реакции, идущие с
изменением степени окисления азота
NH3
– сильный восстановитель
без изменения степени окисления азота
NH3 –
слабое основание 1. аммиак – непрочное соединение,
при нагревании разлагается: 2NH3 ⬄ N2 + 3H2
2. аммиак горит в кислороде:
NH3 + O2 → N2 + H2O
3. окисление аммиака кислородом воздуха в присутствии катализатора:
NH3 + O2 NО + H2O
Pt, Rh
аммиак реагирует с водой:
NH3 + H2O⬄ NH4OH⬄ NH4+ + OH−
гидроксид аммония
аммиак реагирует с кислотами:
NH3 + HCl → NH4Cl
хлорид аммония