Ни диктанта,
Ни контрольной,
Ни стихов и ни задач,
Ни проблем, ни неудач.
Я спокоен, терпелив,
Сдержан я
И не хмурлив.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть

































Происхождение названия
Оазис «Аммон»
в Северной Африке
Бог Амон в образе барана
VIII в. до н.э. (Музей г. Мероэ, Судан)
Происхождение названия
1781-1852 г.
Происхождение названия
1711-1794 г.
Пристли назвал газ «щелочным воздухом
или летучей щелочью»,
поскольку водный раствор
аммиака имел все признаки щелочи.
Это название сохраняется и до сих пор
в большинстве
западноевропейских языков
(нем. Ammonium chloride,
англ. Ammonia, фр. ammoniaque).
История открытия аммиака
+7N ) )
2 5
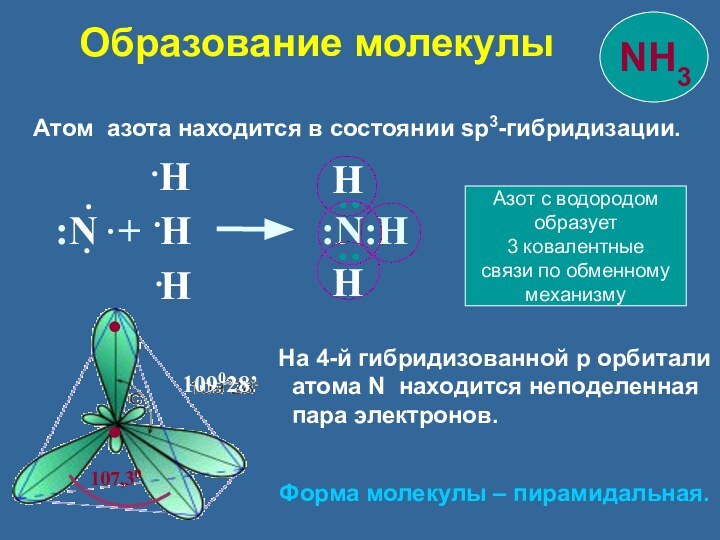
Форма молекулы – пирамидальная.
Н
:
:
Н
Азот с водородом
образует
3 ковалентные
связи по обменному
механизму
Образование молекулы
Азот с водородом
образует
3 ковалентные
связи по обменному
механизму
0
0
H2O
NH3
Физические свойства
Резкий запах.
ТОКСИЧЕН
Молекулярная
кристаллическая
решетка
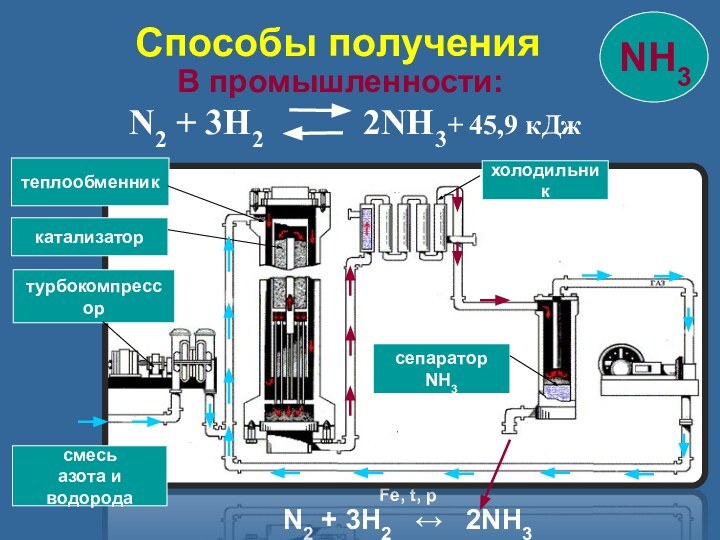
смесь
азота и
водорода
турбокомпрессор
катализатор
теплообменник
холодильник
сепаратор NH3
Способы получения
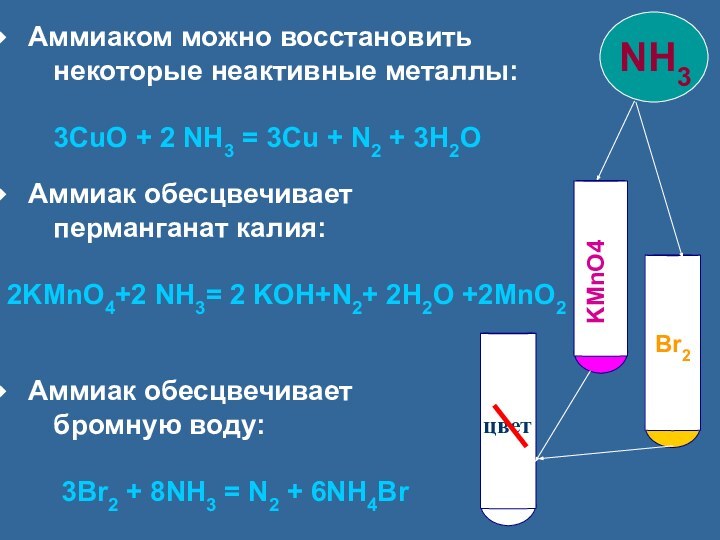
Аммиак обесцвечивает
перманганат калия:
2KMnO4+2 NH3= 2 KOH+N2+ 2H2O +2MnO2
Аммиак обесцвечивает
бромную воду:
3Br2 + 8NH3 = N2 + 6NH4Br
KMnO4
цвет
Гидроксид аммония проявляет
все свойства щелочей !!!
Основные свойства
Взаимодействие с водой
Взаимодействие с кислотами
Дым без огня ?!
(Образуется за счет
образования
хлорида аммония)
Основные свойства
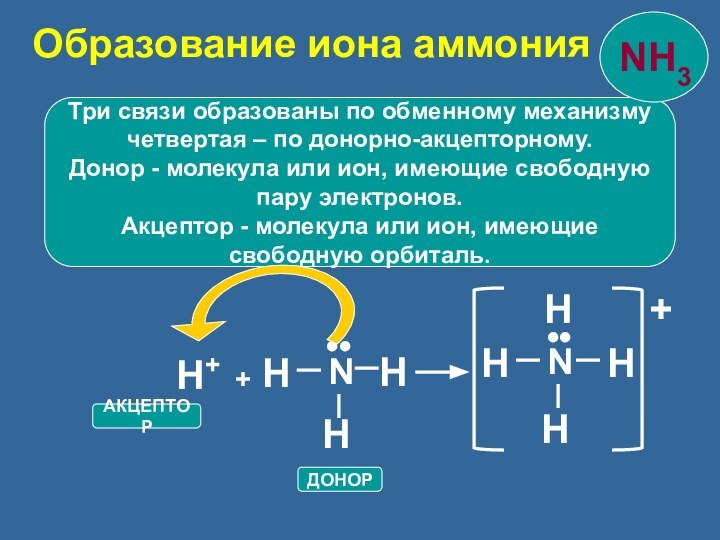
N
H
H
H
••
H+
N
H
H
H
••
H
+
АКЦЕПТОР
ДОНОР
Образование иона аммония
+
Гидразин используют для
получения
ракетного топлива
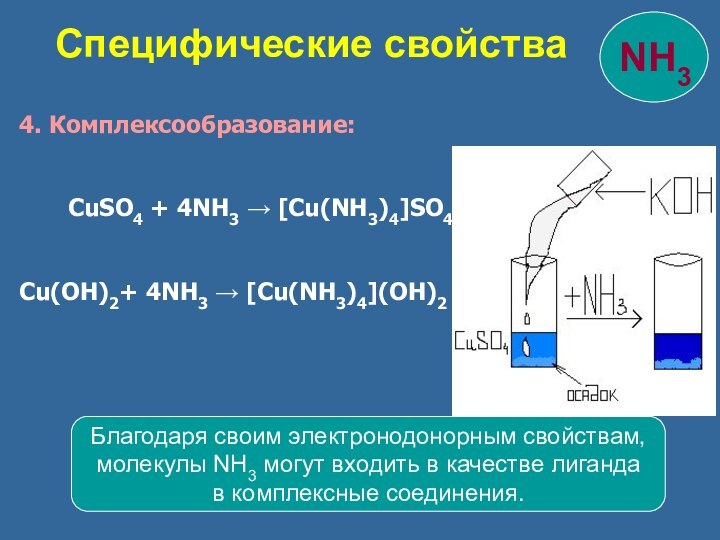
Специфические свойства
Благодаря своим электронодонорным свойствам,
молекулы NH3 могут входить в качестве лиганда
в комплексные соединения.
ПДК аммиака составляет 0,001 мг/л.
Отравление аммиаком
Готовимся к экзамену