Слайд 2
Химический состав подземных вод в каждой точке земной
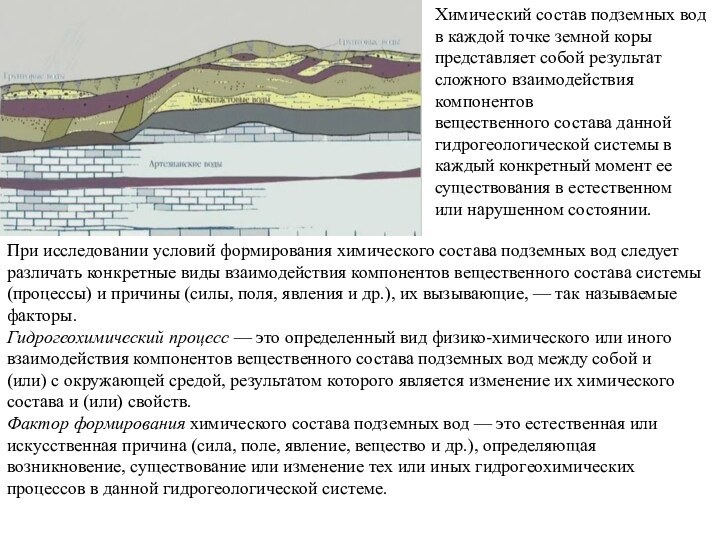
коры
представляет собой результат сложного взаимодействия компонентов
вещественного состава данной гидрогеологической
системы в
каждый конкретный момент ее существования в естественном
или нарушенном состоянии.
При исследовании условий формирования химического состава подземных вод следует различать конкретные виды взаимодействия компонентов вещественного состава системы (процессы) и причины (силы, поля, явления и др.), их вызывающие, — так называемые
факторы.
Гидрогеохимический процесс — это определенный вид физико-химического или иного взаимодействия компонентов вещественного состава подземных вод между собой и
(или) с окружающей средой, результатом которого является изменение их химического состава и (или) свойств.
Фактор формирования химического состава подземных вод — это естественная или искусственная причина (сила, поле, явление, вещество и др.), определяющая возникновение, существование или изменение тех или иных гидрогеохимических процессов в данной гидрогеологической системе.
Слайд 3
Химический состав подземных вод под влиянием комплекса постоянно

действующих в данной гидрогеологической системе факторов и вызываемых ими
процессов обычно находится в состоянии динамического физико-химического равновесия с окружающей
средой. Нарушение этого равновесия вызывается наложением каких-либо временно действующих факторов, изменяющих характер уже существующих процессов или определяющих возникновение новых.
Число факторов, определяющих химический состав подземных вод, чрезвычайно велико. Среди них выделяют следующие группы:
1) физико-химические — свойства воды в различных фазовых состояниях, водных растворов, химических элементов и соединений и т.д.;
2) физические — температура, давление, радиоактивность,
магнетизм, гравитация и др.;
3) физико-географические — климат, особенно осадки и испарение, рельеф, гидрология, условия дренирования и т.д.;
4) геолого-гидрогеологические — тектоника, магматизм и метаморфизм, фациальное строение разреза, минералогический состав пород, фильтрационные свойства пород,
гидродинамические условия, палеогидрогеология и др.;
5) биологические — микрофлора и микрофауна;
6) антропогенные.
Слайд 4
Комплекс основных факторов и процессов, характерных для рассматриваемой
гидрогеологической системы и определяющих
ее гидрогеохимические характеристики и закономерности их
изменений, принято называть условиями формирования химического
состава подземных вод.
В настоящее время относительно глубоко исследована роль
физико-географических, геолого-гидрогеологических, некоторых
физических (температура, давление) факторов в формировании
химического состава подземных вод в различных, в том числе глубоких, частях разреза. За последнее время много сделано в области изучения физико-химических свойств воды и природных растворов, роли живого вещества в подземных водах.
Относительно слабо изучено влияние физических полей Земли (электрического, гравитационного, магнитного).
Слайд 5
При гидрогеохимических исследованиях исходя из анализа результатов влияния

различных факторов и процессов на химический состав подземных вод
и значимости их воздействия на него важно определить среди них главные и второстепенные, прямые и косвенные, действующие постоянно или временно, регионально или локально.
Это является необходимой основой для решения вопросов генезиса подземных вод, выявления региональных гидрогеохимических закономерностей, решения прикладных гидрогеохимических задач и др. Влияние различных факторов на химический состав подземных вод выражается в возникновении (или наличии и последующем изменении) разнообразного, но в целом достаточно ограниченного
круга одних и тех же гидрогеохимических процессов (растворение и выщелачивание, гидролиз, сорбция, диффузия, ионный обмен, осаждение и кристаллизация и др.). Характер этих процессов, их направленность и интенсивность зависят от конкретных особенностей каждой гидрогеологической системы.
Выделяют две основные группы процессов формирования химического
состава подземных вод:
гидрогеохимические;
гидробиохимические — с участием живого вещества.
Слайд 6
Гидрогеохимические процессы
В комплексе гидрогеохимических процессов условно можно
выделить:
1)
процессы обмена веществом водовмещающей породы
и окружающей среды с раствором,
в том числе повышающие
(растворение и выщелачивание, десорбция, гидролиз, комплексо-
образование и др.) и понижающие (осаждение и кристаллизация,
высаливание, сорбция и др.) минерализацию подземных вод;
2) процессы качественного и количественного перераспределения
вещества в самих природных растворах (конвективный и диффузионный массоперенос).
Следует четко представлять себе сопряженность и взаимосвязь указанных процессов и возможность перехода одного в другой при достижении определенных химических или физико-химических констант (произведение растворимости, величина обменной емкости и др.).
Слайд 7
Растворение и выщелачивание.
Растворение в гидрогеохимии — процесс
перевода в подземные воды из окружающей среды (горной породы)
любого (минерального, органического, газов различного генезиса) вещества в ионной или молекулярной форме. Предельно возможная концентрация вещества в растворе при нулевой разности химических потенциалов соответствует насыщению его при данных условиях. Эта величина называется растворимостью (для труднорастворимых веществ — произведением растворимости) и зависит кроме природы вещества от температуры, давления (слабо) и состава раствора. Например, при 10°С (близкую температуру имеют грунтовые воды средней полосы) и атмосферном давлении в 100 г воды растворяется 35,86 г NaCl; 0,007 СаСО3; 1,194 г СО2 (Лурье, 1971).
При температуре 8,5°С в 100 г воды растворяется
0,193 г CaSО4 . 2H2О ,
а в насыщенном растворе NaCl — уже 0,678 г.
Слайд 8
Скорость растворении зависит от природы и минеральной формы

вещества, давления, температуры, степени дисперсности, состава раствора и др.
Однако определяется она скоростью самой медленной для данных условий реакции — так называемой лимитирующей скоростью. Чаще, говоря о растворении, имеют в виду процесс перевода в раствор твердого вещества горных пород.
Растворение — полное разрушение кристаллической или аморфной структуры минералов.
Выщелачивание — комплекс процессов, приводящих к избирательному выводу из породы какого-либо, обычно наиболее растворимого в данных условиях, компонента.
Например, при определенных условиях могут быть полностью растворены горные породы, состоящие из таких простых солей, как NaCl, KCI, Na2SО4 , Na2CО3 , CaSО4 * 2H2О, CaCО3 и др.
В то же время горные породы, содержащие эти соли в качестве примесей, будут постепенно выщелачиваться подземными водами. На первых этапах промывания горной породы из нее будут наиболее растворимые соединения — хлориды щелочных и щелочно-земельных металлов, затем сульфаты и в последнюю очередь наименее растворимые — карбонаты и силикаты.
Слайд 9
При наличии факторов, стимулирующих растворение, труднорастворимые компоненты могут

выщелачиваться наряду с легкорастворимыми. Например, поступление СО2 (термометаморфического, биохимического
или иного генезиса) способствует
растворению кальцита в морских карбонатных породах наряду с сульфатами и хлоридами.
В зависимости от степени промытости пород в этом случае могут формироваться воды HCО3—SО4—Cl, HCО3—SО4 , SО4—НСО3, НСО3 состава (таковы, например, кисловодские, железноводские, пятигорские нарзаны). В подобных случаях, когда известен реагент, усиливающий процесс, говорят об углекислотном, сернокислотном выщелачивании и др.
Компоненты состава подземных вод присутствуют в растворе как в виде простых частиц (ионов, молекул), так и в виде ассоциатов или комплексных соединений различной степени сложности.
Например, в воде, содержащей сульфаты и карбонаты кальция и магния, кроме Са2 + , Mg2+ , HCО3- , СО32- , SO42- будут присутствовать СаСО30, MgСО30 , CaHCO3+, MgHCO3+, CaSO40, MgSО40.
Особенно существенное значение для химического состава подземных вод имеют комплексы Fe и AI, ряда металлов — микрокомпонентов, фосфатов, F- и др.
Слайд 10
Комплексообразование стимулирует процесс растворения, поскольку в присутствии анионов
и катионов, комплексующихся с компонентами растворяемого вещества, растворимость и
скорость
растворения последнего увеличиваются.
Выделение веществ из природных растворов в твердую фазу
приводит к снижению их концентрации в растворе, изменению
его состава и является причиной уменьшения порового пространства горных пород. Природа явлений, вызывающих выделение твердой фазы, может быть различна. Это прежде всего концентрирование природных растворов (вплоть до состояния насыщения) за счет дополнительного поступления вещества или вывода из системы растворителя — воды, а также несовместимость состава смешивающихся природных растворов.
Слайд 11
Результаты концентрирования за счет поступления вещества наиболее ярко

проявляются в растворах, содержащих относительно слаборастворимые соединения — карбонаты
кальция и магния,
сульфаты кальция, концентрация насыщения которыми природных вод может быть достигнута довольно быстро в процессе взаимодействия воды и соответствующей породы (известняка, доломита, гипса, ангидрита). Однако, как уже говорилось, в условиях стимуляции растворения за счет комплексообразования, поступления газов (например, СО2 биохимического или иного генезиса), а также при изменении температуры и давления растворимость различных соединений существенно меняется и не соответствует таковой в дистиллированной воде. Соответственно
изменяются и величины концентраций веществ, при которых начинается
их кристаллизация.
Большая группа процессов выведения вещества из природных растворов в твердую фазу связана с концентрированием и перенасыщением растворов при удалении "растворителя", т.е. молекул воды. В природных условиях этот механизм может быть различен:
испарение,
вымораживание,
гидролиз.
Слайд 12
Испарение — один из важнейших процессов формирования химического

состава грунтовых вод в аридных областях, где оно вызывает
континентальное засоление. Гидрогеохимические следствия испарительных процессов определяются составом исходной воды. По модели Харди—Эгстера, которая основана на концепции химического
разделения, предполагается, что при осаждении из раствора бинарной соли под влиянием испарения в растворе увеличивается содержание иона, присутствовавшего в нем изначально в более высокой относительной концентрации, и снижается содержание
иона, присутствовавшего в относительно меньшей концентрации.
Исходя из этого при испарении грунтовых вод, характеризующихся соотношением (ммоль) НСО3- + 2СО32- > 2Са2 + , по мере достижения произведения растворимости и осаждения кальцита, а также, возможно, сепиолита MgSi3О6 (OH)2 и доломита, состав раствора должен трансформироваться в щелочной, гидрокарбонатный натриевый с более высокой, чем исходная, минерализацией.
Таким образом образуются грунтовые воды содового состава. Дальнейшая трансформация состава происходит за счет выпадения в осадок гипса. При этом если концентрация кальция, оставшегося после осаждения кальцита, ниже, чем концентрация сульфат-иона,
в составе раствора будут преобладать сульфаты и хлориды натрия и магния, если выше — рассол будет содержать хлориды натрия, кальция и магния. Так формируются широко распространенные гидрокарбонатно-сульфатные, сульфатно-хлоридные и хлоридные
натриевые и магниево-натриевые воды с минерализацией до 10 г/л и более. При соотношении НСО3- + 2СО32+ < 2С а2 + раствор после осаждения кальцита трансформируется в почти нейтральный сульфатный и хлоридный более высокой минерализации с последующей еще большей его концентрацией.
Слайд 13
Иной стадийностью характеризуется процесс испарения морских вод, так

называемый галогенез — формирование галогенных осадков в процессе концентрирования
рассолов под влиянием испарения в открытых бассейнах. Несмотря на то что галогенез — это процесс, происходящий на поверхности земли (в лагунах, соленых озерах, лиманах и др.), он представляет принципиальный интерес для гидрогеохимии, поскольку именно процессами па-
леогалогенеза и последующей метаморфизацией с большой долей вероятности может быть объяснен генезис состава глубокозалегающих высокоминерализованных подземных вод.
Галогенез характеризуется стадийностью, которая определяется растворимостью различных соединений. Например, в процессе концентрирования морской воды при достижении определенных величин ее минерализации последовательно выпадают в осадок карбонаты, гипс, галит, эпсомит (MgSО4 • 7 Н2О) , сильвин (КС1), карналлит (КС1 • MgCl2 • 6Н2О) , бишофит (MgCl2 • 6Н2О ).
При этом остаточный раствор все более концентрируется за счет солей с более высокой растворимостью. На последней (так называемой эвтонической) стадии концентрирования морской воды рассол имеет хлоридный магниевый состав и минерализацию более 440 г/л.
Слайд 14
Криогенное концентрирование (вымораживание) — процесс, характерный для подземных

вод зоны развития мерзлоты, особенно в слое сезонного промерзания—протаивания.
Менее заметны проявления его в немерзлотных районах при сезонном промерзании.
Состав слабоминерализованных грунтовых вод тундровойи таежной зон часто определяется содержанием значительных количеств (до 80 мг/л и более) H4SiО4 в истинно растворенной и частично коллоидной форме. Генезис ее связан с процессами вымораживания вод из пород, которые способствуют переводу чрезвычайно труднорастворимых кристаллических форм SiО2 в более растворимую — аморфную. Поэтому, в частности, содержание H4SiО4 в пробах, отобранных в начале лета, в период интенсивного таяния, существенно выше, чем в более поздних пробах.
Совместное воздействие процессов испарения и вымораживания на состав природных растворов можно наблюдать на поверхностях многолетних наледей, где скапливается белый, желтоватый, сероватый порошкообразный налет солей — наименее растворимых
в природных водах данного региона соединений (SiО2 ; СаСО3 ; CaSО4 • 2H2О) .
Кроме того, при криогенном концентрировании раствора вместе с образованием льда происходит формирование твердой фазы тех соединений, произведение растворимости которых достигается при данной температуре. Из пресных вод выпадают в осадок силикаты и карбонаты кальция, затем магния, из соленых — сульфаты кальция и натрия. Таким образом, в растворе начинают преобладать гидрокарбонаты натрия (содовые подмерзлотные воды), сульфаты и хлориды магния и натрия. Кроме того, установлено,
что талая вода обладает более высокой растворяющей активностью.
Слайд 15
Высаливание — процесс выведения компонента из раствора при
смешении
его с другим раствором, содержащим одноименный ион.
Например, при смешении
растворов, содержащих хлориды щелочных и щелочноземельных металлов, NaCl может выпадать в
осадок при концентрации в растворе, значительно меньшей, чем
концентрация его насыщения при данных температуре и давлении
в дистиллированной воде. Таким образом, высаливание можно
рассматривать как процесс, способствующий осаждению вещества
из раствора.
Важным следствием рассмотренных, а также некоторых других
процессов вывода веществ из подземных растворов является формирование в толще горных пород так называемых геохимических барьеров — участков концентрации тех или иных элементов, маркирующих зоны контакта между участками разреза с различными геохимическими и гидрогеохимическими условиями.
Слайд 16
Сорбционные процессы термодинамически обусловлены стремлением системы к минимуму
энергии свободной поверхности и выражаются в компенсации сорбируемыми из
раствора компонентами ненасыщенных валентных связей твердой фазы с образованием нового вещества (хемосорбция) или с сохранением химической индивидуальности сорбента и сорбата (физическая сорбция).
Для физической сорбции характерно установление динамического
равновесия между процессами адсорбции и десорбции, так называемое сорбционное равновесие, которое при неизменных условиях (температура, давление, концентрация раствора) может существовать сколь угодно долго. Хемосорбция в отличие от физической, как правило, необратима.
Слайд 17
Масштабы сорбционных процессов кроме природы (заряда,
радиуса иона и
др.) вещества определяются величиной поверхности
раздела фаз, поэтому наилучшими сорбционными
свойствами
характеризуются высокодисперсные породы, минеральные и органические коллоиды. Это прежде всего глинистые минералы: каолинит, галлуазит, монтмориллонит и другие; свежеосажденные
коллоидные осадки, например гидроокиси железа, алюминия,
гели кремниевой кислоты; органические коллоиды, главным образом гумус. Большинство указанных веществ характеризуются
отрицательным зарядом частиц и, следовательно, сорбируют катионы.
Сорбция анионов возможна, но изучена слабо. Известно, что сорбировать анионы могут некоторые глинистые минералы,
апатит и другие фосфаты (при t> 100°С), полевые шпаты, слюды.
Кроме того, в контакте с концентрированными хлоридными растворами глины могут иметь не отрицательный, а положительный заряд и сорбировать такие анионы, как В, J, F.
Слайд 18
Сорбционная способность (или энергия поглощения) катионов тем выше,

чем ниже их энергия гидратации. Поэтому по сорбционной способности
катионы образуют следующие ряды (по К.К. Гедройцу ) : Li+ < N a + < Н + < NH4+< К+ ;
Mg2 + < С а2+ < Sr2 + < Ва2+ ; Al3+ < Fe3+ ,
а для разнозарядных катионов: Ме+ < Ме2+ < Ме3+ , т.е.
чем меньше заряд катиона, тем хуже он сорбируется. Однако следует отметить, что существуют отклонения от указанной закономерности, связанные,
по-видимому, с явлением селективности различных веществ к сорбции одного и того же катиона.
Сорбционные процессы могут оказывать существенное влияние на химический состав подземных вод, особенно связанных с высокодисперсными породами, снижая (сорбция) или увеличивая (десорбция) минерализацию и в некоторых случаях величину рН.
Очевидно, что изменения в составе подземных вод под влиянием сорбции наиболее значительны в случаях нарушения существующего в системе
вода—порода сорбционного равновесия (например, при изменении гидродинамических или гидрогеохимических условий) и затухают по мере насыщения сорбционной емкости породы. Прогноз сорбционных процессов имеет важное значение при оценке возможностей "самоочищения" загрязненных подземных вод при фильтрации через высокодисперсные породы.
Слайд 19
Ионный обмен — процесс, тесно связанный с сорбцией

и обусловленный различием химических потенциалов ионов раствора и твердой
фазы с адсорбированными ею ионами. Количество адсорбированных ионов (на поверхности и в межпакетных пространствах
глинистых минералов), выраженное в мг-экв/100 г сухой породы или в % от веса сухого вещества, называют емкостью поглощения. В зависимости от качественного состава (энергии поглощения) адсорбированных ионов, величины емкости поглощения породы, а также от состава и концентрации компонентов раствора состав обменных ионов (так называемый поглощенный или ионообменный комплекс) одной и той же породы может
быть различным. В общем случае реакции обмена идут самопроизвольно в сторону вытеснения ионов с низкой энергией поглощения ионами с более высокой энергией поглощения. Так, для катионов в соответствии с «рядами Гедройца» А13 + раствора
должен вытеснять адсорбированные Са2 + , Mg2+ , К+ ; Са2+ раствора — соответственно
Mg2 + , К+ , Na+ ; Mg2 + раствора — К+, Na+ .
Таким образом, при инфильтрации пресных НСО3—Са вод в толщу засоленных глин возможны переход Na + в раствор и формирование HCО3 — Na вод.
Поглощенный комплекс глин при этом обогащается кальцием:
Са2+ (р-р) + 2Na+ (п.к.) ↔ 2Na + (р-р) + Са2+ (п.к.).
Слайд 20
Очевидно, что процессы ионного обмена должны быть наиболее

развиты в самой верхней части гидрогеологического разреза, где ионообменная
способность горных пород постоянно поддерживается и возобновляется благодаря процессам механического и химического выветривания, способствующим диспергации
и коллоидообразованию. Кроме того, для этой зоны (свободного водообмена) характерны слабоминерализованные воды, концентрация компонентов в которых соизмерима с емкостью поглощения горных пород. Минералы глин в этих условиях несут отрицательный заряд, что стимулирует обмен катионов. Следует отметить, что именно для этой зоны на участках разгрузки, в болотных ландшафтах и в условиях промышленного загрязнения характерны процессы образования свежих коллоидных осадков, в первую очередь гидроокиси железа, алюминия, марганца, а в мерзлотных ландшафтах, кроме того, геля кремниевой кислоты. По С Р . Крайневу, гидроокислы в щелочной среде сорбируют катионы, а в кислой — анионы и, следовательно, могут способствовать как анионному,
так и катионному обмену.
В природных условиях процесс ионного обмена в чистом виде наблюдается сравнительно редко, обычно он сопряжен с другими (сорбционными, диффузионными, осмотическими) процессами, характерными для слабопроницаемых пород.
Слайд 21
Гидролиз. Особенностью растворения некоторых природных минеральных соединений, и
в частности таких широко распространенных, как силикаты, является формирование
на растворяющейся поверхности пленки вторичных руднорастворимых соединений (так называемой инконгруэнтной оболочки), препятствующей дальнейшему растворению. Наиболее распространенным природным процессом, для которого это характерно, является гидролиз силикатных и алюмосиликатных минералов. Этот процесс имеет важнейшее значение для формирования коры выветривания кристаллических пород и состава трещинных вод горно-складчатых областей гидрогеологических массивов. Гидролиз — реакция
между ионами Н+ и ОН- воды и ионами (элементами, ассоциатами)
растворяемого минерального вещества с образованием
слабодиссоциирующих соединений и изменением рН природных растворов.
Слайд 22
В системе, содержащей анионы слабых кислот (H3SiO4-, СО32-,
HCО3-
, HS- ) и катионы сильных оснований, идет гидролиз
анионов
со связыванием протона. Например:
НСО3- + Н2О ↔ НСО3- + Н+ + ОН- ↔ Н2СО3 + ОН-
HS- + Н2О ↔ HS- + Н+ + ОН- ↔ H2 S + ОН-.
При этом рН раствора повышается.
Гидролиз катионов происходит, если в растворе присутствуют
анионы сильных кислот, элементы, образующие труднорастворимые
гидроокиси, или катионы — сильные комплексообразователи
(Fe3+ , А13+):
Fe3+ + 3 Н2О ↔ Fe3+ + 3Н+ + 3ОН- ↔ Fe(OH)3↓+ 3Н+ .
рН раствора понижается.
Слайд 23
В природных условиях изолированные процессы гидролиза
катионов и анионов
наблюдаются чрезвычайно редко, поскольку
природные растворы обычно многокомпонентны и содержат
анионы
как слабых, так и сильных оснований и различные катионы.
Указанные выше реакции протекают одновременно, и рН раствора
определяется в конечном счете соотношением констант диссоциации вновь образованных кислот и оснований. Алюмосиликатные минералы в процессе гидролиза медленно
разлагаются водой с образованием вторичных глинистых минералов
(каолинита, монтмориллонита и др.), причем по мере образования
инконгруэнтной оболочки процесс постепенно затухает. В
природных условиях в зоне гипергенеза дальнейшее растворение
может происходить только при удалении оболочки механическим
путем или в процессе сопряженных химических реакций.
Слайд 24
Диффузия в гидрогеохимии — это процесс перераспределения вещества

в природных растворах или в системе "вода—порода« под влиянием
градиента химического потенциала. При наличии в слоистой системе разности химических потенциалов какого-либо компонента (например, различие содержаний С1- в водоносных горизонтах I и II, разделенных глинистым слоем) возникает направленный диффузионный поток через разделяющий слой глин из горизонта I с более высоким химическим потенциалом этого компонента к горизонту II с меньшим его значением.
В водоносных и слабопроницаемых отложениях, граничащих с
галогенными толщами, также существуют градиенты химических
потенциалов и, следовательно, диффузионные потоки. Приведенные
схемы являются едва ли не самыми типичными примерами
диффузионных процессов в природных гидрогеохимических системах.
Некоторые исследователи считают диффузию определяющим процессом в формировании состава глубоких высокоминерализованных вод, генетически связывая их с древними галогенными толщами.
Слайд 25
В гидрогеохимической литературе часто встречается термин
"диффузионное выщелачивание", под
которым понимают диффузию компонента из поровых растворов глинистых пород
под влиянием
градиента коцентраций. Диффузионное выщелачивание глин
возможно в тех случаях, когда градиент концентраций обусловлен
меньшим содержанием компонента в конвективном потоке, т.е. в
водоносном горизонте, контактирующем с глинами, или в макропорах самих глин. Таким образом, за счет диффузии может происходить рассоление глин с изменением состава их поглощенного комплекса. Возможен и обратный процесс — диффузионное засоление глин, характерное для аридных областей.
В природных условиях диффузия обычно является составной
частью сложного комплекса гидрогеохимических процессов в
слабопроницаемых породах, зависящих также от особенностей
гидродинамических условий (соотношения фильтрации и диффузии) при процессе "перетекания".
Слайд 26
Для оценки относительной роли конвективной и диффузионной
составляющих потока
применяют число Пекле (Ре):
где V — скорость фильтрации, см/с;
l — расстояние, см;
D — коэффициент диффузии, характеризующий способность вещества к проникновению диффузионным путем в иную неподвижную среду и представляющий собой физическую константу, см2/с.
Считают, что при Ре < 0,05 распределение компонента в системе
определяется только молекулярной диффузией,
при Ре > 10 — только конвекцией.
Промежуточные значения характеризуют конвективно-диффузионный перенос. Очевидно, что формирование химического состава подземных вод главным образом под влиянием диффузионных процессов характерно для элементов гидрогеологического разреза с «малыми» скоростями движения подземных вод (зона затрудненного водообмена, глинистые толщи, галогенные породы и др.).
Слайд 27
Гидробиохимические процессы
Активная жизнедеятельность микроорганизмов в подземных водах —

один из важнейших факторов формирования их химического состава. В
настоящее время установлена большая роль живого вещества в общем круговороте химических элементов, особенно углерода, азота, железа, серы, фосфора, кремния, калия.
В цикле развития (в процессах фото- и хемосинтеза) живые организмы (в том числе микроорганизмы) и растения синтезируют из минеральных веществ органические.
Последние при разрушении и отмирании живого вещества снова минерализуются, что также происходит с участием микроорганизмов. Поскольку все эти процессы принципиально возможны только в присутствии воды, в гидросфере они распространены
практически всюду, где термобарические и концентрационные условия допускают возможность существования и развития живого вещества. Энергию, необходимую для жизнедеятельности, микроорганизмы получают в процессе переноса электронов от веществ с большей электроотрицательностью к веществам с меньшими ее величинами при активном участии ферментов, различных для разных видов бактерий. Ферменты катализируют эти реакции, облегчая возможность химического контакта (переноса электрона) между ними. С помощью своей ферментативной системы микроорганизмы
способны во много раз ускорять окислительно-восстановительные реакции в системе "вода—порода". Кроме того, непосредственное воздействие на геологическую среду вообще и на формирование химического состава подземных вод в частности оказывают продукты жизнедеятельности живого вещества, особенно такие химически активные, как СО2, H2S, Н2, О2.
Наиболее важными биохимическими процессами в подземных водах являются биогенная генерация СО2, сульфофикация и сульфатредукция, нитрификация и денитрификация, метанообразование, водородредукция.
Слайд 28
Биогенная генерация СО2 — наиболее широко распространенный
биохимический процесс,

непосредственно влияющий на химический
состав подземных вод. При любом изменении
содержания СО2 — потреблении (или выделении) его живым веществом — происходит сдвиг равновесия реакций протонирования и соответственно уменьшается (или увеличивается) содержание Н+ и HCO3- ,т.е. происходит подщелачивание (или подкисление) природного раствора. При этом создаются условия для выпадения CaCО3 , CaMg(CО3)2 в осадок или, наоборот, для их растворения.
Именно с этими процессами, как правило, связана кальцитизация
по трещинам, столь характерная для обогащенных органическим
веществом сред: каустобиолитов, битуминозных терригенных пород,
зон контактов с нефтегазовыми залежами в условиях затрудненного
водообмена.
Процессы генерации больших количеств СО2 широко развиты при микробиологическом разрушении органических веществ нефтяного
ряда при наличии условий для развития аэробной флоры
(метан- или пропанокисляюших бактерий).
Слайд 29
Важное значение в формировании геохимических и гидрогеохимических условий

имеют сульфофикация, т.е. окисление элементарной и восстановленной форм серы
до SO42- — тионовыми, пурпурными и серобактериями (аэробными и анаэробными), и
сульфатредукция — восстановление элементарной и окисленной форм серы до H2S бактериями рода Desulfovebrio и др. Эти процессы представляют собой важнейшие этапы круговорота серы в природе. Процесс сульфофикации серобактериями характерен для аэробных условий. Он происходит по схеме:
2H2S + О2 →2Н2О + S2 + 65 ккал,
S2 + 3О2 + 2 Н2О → 2H2SО4 + 283 ккал.
Образующаяся на промежуточном этапе сера накапливается в клетках серобактерий и затем окисляется до серной кислоты. При наличии в системе кальция возможно продуцирование гипса.
Микроорганизмы из рода Thiobacillus не накапливают серу в клетках, в остальном процесс идет аналогично рассмотренному с образованием агрессивных по отношению к восстановленной сере соединений. Например, при жизнедеятельности Th. ferrooxidans
образуется сульфат окиси железа, который в свою очередь является сильным окислителем сульфидов:
2FeS2 + 7,5О2 + Н2О → Fe2(SО4)3 + H2SО4 .
Данный процесс широко распространен в районах сульфидных месторождений. Н.Н. Ляликовой установлено, что он ускоряет окисление сульфидов в 10—30 раз. При этом происходит концентрирование металлов в растворимой форме в кислых рудничных
водах — явление, уже использующееся для извлечения металлов из бедных руд в промышленных целях.
Слайд 30
В процессе сульфофикации понижается рН природных растворов, в

них возрастает содержание SO42-. Кроме того, образующаяся H2SО4 агрессивно
воздействует на карбонатные, силикатные, алюмосиликатные породы, способствуя их разложению и
растворению, обогащению подземных вод углекислотой, сульфатом окиси железа, органическими кислотами.
Процесс сульфатредукции возможен лишь в анаэробных условиях и заключается в восстановлении окисленных форм серы (SO42-) до H2S анаэробными сульфатредуцирующими бактериями. Известно, что чисто химическое разложение сульфатов под влиянием температуры и давления в пределах доступной изучению части
разреза литосферы из-за очень высокой энергии связи кислорода и серы в ионе SO42- может происходить лишь в высокотемпературных условиях (большие глубины, районы современного вулканизма).
Однако сульфатредуцирующие бактерии с помощью ферментов способны разорвать эту связь, используя для этого энергию окисления водорода или органического вещества. В зависимости от использования в качестве энергетического материала газообразного
водорода (Н2 ) или органического вещества подземных вод и горных пород (Сорг.) выделяют автотрофную и гетеротрофную сульфатредукцию:
SO42- + 4Н2 = S2- + 4Н2О ;
SO42- + 2Cорг.= S2- + 2СО 2 .
Процесс сульфатредукции может идти при температурах от 0—2 до 70—80°С и имеет важнейшее значение для формирования химического состава пластовых вод артезианских платформенных и межгорных бассейнов.
Слайд 31
Сульфатредукция обусловливает сразу несколько гидрогеохимических следствий: генерируются значительные
количества (от миллиграммов до 1—4 г/л) сероводорода
(S2- +
2Н2О = H2S + 2ОН- ) — одного из важнейших потенциал задающих веществ. При этом создаются восстановительные условия (Eh 300 мВ и менее) и выпадают в осадок в виде сульфидов Fe, Си, РЬ и др. Повышение рН среды приводит к смещению карбонатных равновесий в сторону СО32-, следствием чего является осаждение СаСО3.
При автотрофной сульфатредукции выделяется значительное,
вплоть до пересыщения, количество углекислоты, которая при
наличии в водах Са2+ и Mg2+ стимулирует осаждение карбонатов
этих элементов. За счет редукции сульфатов и осаждения карбонатов кальция и магния могут происходить существенное снижение минерализации подземных вод и смена доминирующих ионов.