Слайд 2
Уровни выполнения экзаменационной работы
неудовлетворительный – 0–31 / 0–12,
удовлетворительный –32–56 / 13–35,
хороший – 57–77 / 36–56,
отличный –78–100 / 57–66
Слайд 3
Результаты выполнения заданий, проверяющих усвоение
содержания блока «Теоретические основы

химии»
Строение электронных оболочек атомов элементов первых четырех периодов: s-,
p- и d-элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов - 80,8%
Закономерности изменения химических свойств элементов и их соединений по периодам и группам - 74,7%
Общая характеристика металлов IА–IIIА групп в связи с их положением в п.с.х.э. и особенностями строения их атомов - 72,5%
Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в п.с.х.э. и особенностям строения их атомов - 62,3%
Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в п.с.х.э. и особенностями строения их атомов - 77,6%
Ковалентная химическая связь, ее разновидности, механизмы образования. Характеристики ковалентной связи. Ионная связь. Металлическая связь. Водородная связь - 76,2%
Электроотрицательность. Степень окисления и валентность химических элементов - 88,1%
Слайд 4
8. Вещества молекулярного и немолекулярного строения. Зависимость свойств
веществ от особенностей их кристаллической решетки - 71,2%
9. Классификация
химических реакций в неорганической и органической химии - 76,8%
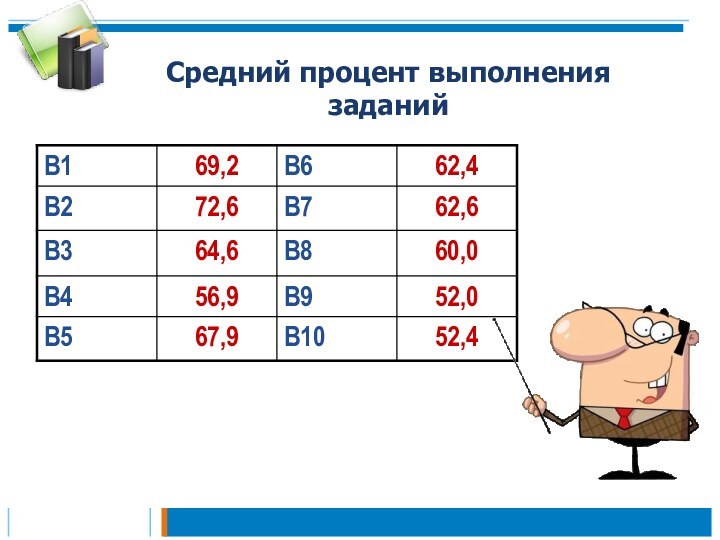
10. Скорость реакции, ее зависимость от различных факторов - 64,6%
11. Тепловой эффект реакции - 72,6%
12. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов - 65,5%
13. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты - 77,8%
14. Реакции ионного обмена - 83,0%
15. Гидролиз солей - 73,7%
16. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от неё –
72,2%
17. Электролиз расплавов и растворов - 64,6%
18. Механизмы реакций замещения и присоединения в органической химии. Правило
В.В. Марковникова - 62,9%
Слайд 5
Пример 1
Верны ли следующие суждения о металлах и
их соединениях?
А. Высшие оксиды всех элементов IIA группы проявляют
только основные свойства.
Б. Восстановительные свойства магния выражены сильнее, чем у бериллия.
1) верно только А (14%)
2) верно только Б (43%)
3) верны оба суждения (37%)
4) оба суждения неверны (5%)
Слайд 6
Пример 2
Скорость реакции омыления сложного эфира
CH3COOC2H5 + OH
→ CH3COO + C2H5OH
не зависит от
1) температуры (26%)
2) концентрации
щелочи (11%)
3) концентрации спирта (52%)
4) концентрации эфира (11%)
-
-
Слайд 7
Пример 3
Химическое равновесие в системе
С2Н5ОН + СН3СООН →
СН3СООС2Н5 + Н2О – Q
смещается в сторону продуктов реакции
при
1) добавлении воды (14%)
2) уменьшении концентрации уксусной кислоты (18%)
3) увеличении концентрации эфира (16%)
4) удалении воды (51%)
→
Слайд 8
Пример 4
Взаимодействие 2-метилпропана и брома при комнатной температуре
на свету
1) относится к реакциям замещения
2) протекает по радикальному
механизму
3) приводит к преимущественному образованию 1-бром-2-метилпропана
4) приводит к преимущественному образованию 2-бром-2-метилпропана
5) протекает с разрывом связи C – C
6) является каталитическим процессом
Слайд 9
Блок «Неорганическая химия»
Классификация и номенклатура неорганических веществ -
85,4%
Характерные химические свойства простых веществ – металлов: щелочных, щелочноземельных,
алюминия; переходных металлов – меди, цинка, хрома, железа - 73,4%
Характерные химические свойства простых веществ –неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния - 73,4%
Характерные химические свойства оксидов - 71,7%
Характерные химические свойства кислот, оснований и амфотерных гидроксидов – 66,1%
Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка) - 62,2%
Реакции, подтверждающие взаимосвязь различных классов неорганических веществ – 60,1%
Слайд 10
Пример 5
Карбонат бария реагирует с водным раствором каждого
из двух веществ:
1) H2SO4 и NaOH (28%)
2) NaCl и
CuSO4 (13%)
3) HCl и CH3COOH (50%)
4) NaHCO3 и HNO3 (8%)
Слайд 11
Пример 6
В схеме превращений
ZnO → X1 → X2
→ Zn(OH)2
веществами Х1 и Х2 могут быть соответственно
1) ZnS
и ZnSO4 (17%)
2) ZnSO4 и ZnCl2 (52%)
3) Zn(OH)2 и Zn (20%)
4) ZnCO3 и Zn3(PO4)2 (10%)
Слайд 12
Блок «Органическая химия»
Теория строения органических соединений. Изомерия структурная
и пространственная. Гомологи и гомологический ряд - 69,4%
Типы связей
в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа - 69,4%
Классификация и номенклатура органических соединений - 81,9%
Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола) - 66,1%
Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола - 59,1%
Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров - 66,6%
Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот - 60,0%
Биологически важные вещества: жиры, белки, углеводы - 66,0%
Взаимосвязь органических веществ – 71,4%
Слайд 13
Пример 7
С раствором гидроксида натрия реагирует
1) CH2 =
CH2 (16%)
2) CH3 – O – CH3 (8%)
3) CH3
– CH2 – OH (17%)
4) C6H5OH (59%)
Слайд 14
Пример 8
С 2-аминопропановой кислотой реагируют
1) этан
2) сульфат натрия
3)
пропанол-1
4) толуол
5) гидроксид бария
6) бромоводород
Слайд 15
Пример 9
В схеме превращений HC
≡ CH → X → CH3COOH
веществом Х является
1) CH3CHO(71%)
2)
CH3 − CO − CH3 (8%)
3) CH3 − CH2OH(15%)
4) CH3 − CH3 (5%)
Слайд 16
Пример 10
Напишите уравнения реакций, с помощью которых можно
осуществить следующие превращения:
X1→бензол
С2Н4, Н
+
X2
X3
X4
KMnO4, H2SO4, t
°
CH3OH, t, H
+
°
CO2
Слайд 17
Блок «Методы познания веществ и химических реакций»
Раздел «Экспериментальные

основы химии»
Правила работы в лаборатории. Лабораторная посуда и оборудование.
Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. Научные методы исследования химических веществ и превращений. Методы разделения смесей и очистки веществ. Качественные реакции на неорганические вещества и ионы. Идентификация органических соединений - 58,4%
Основные способы получения углеводородов (в лаборатории) - 59,9%
Основные способы получения кислородсодержащих соединений (в лаборатории) - 69,3%
Раздел «Основные представления о промышленных способах получения важнейших веществ»
1. Понятие о металлургии: общие способы получения металлов. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия. Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки – 63,5%
Слайд 18
Раздел «Расчеты по химическим формулам и уравнениям реакций»
Вычисление
массы растворенного вещества, содержащегося в определенной массе раствора с
известной массовой долей – 52,0%
Расчеты объемных отношений газов при химических реакциях – 73,0%
Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ – 52,4%
Расчеты теплового эффекта реакции – 71,0%
Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества – 31,8%
Нахождение молекулярной формулы вещества – 34,3%
Слайд 19
Пример 11
Верны ли следующие суждения о правилах техники
безопасности?
А. Пробирку с бензолом запрещается нагревать на открытом пламени.
Б.
Для приготовления раствора серной кислоты нужно приливать воду к концентрированной кислоте.
1) верно только А (46%)
2) верно только Б (12%)
3) верны оба суждения (29%)
4) оба суждения неверны (13%)
Слайд 20
Пример 12
Синтез-газ, используемый в производстве метанола, представляет собой
смесь
1) CH4 и CO2 (22%)
2) CO2 и H2 (14%)
3)
CH4 и CO (13%)
4) CO и H2 (49%)
Слайд 21
Пример 13
В 15%-ном растворе серной кислоты массой 300
г растворили карбид алюминия. Выделившийся
при этом метан занял объем
2,24 л (н.у.). Рассчитайте массовую долю серной кислоты в
полученном растворе.
Слайд 22
Результаты выполнения заданий высокого уровня сложности
Слайд 23
Общая характеристика уровня подготовки
Минимальный уровень: тестовый балл –
0–31;
первичный балл – 0–12; процент выпускников данной
категории – 6,94
(5419 человек)
Удовлетворительный уровень: тестовый балл – 32–56;
первичный балл – 12–35; процент выпускников данной
категории – 32,19 (25 130 человек)
Хороший уровень: тестовый балл – 57–77;
первичный балл – 36–56; процент выпускников данной
категории – 49,75 (38 838 человек)
Отличный уровень: тестовый балл – 78–100;
первичный балл – 57–66; процент выпускников данной
категории – 11,11 (8674 человека)
Слайд 24
Средний процент выполнения заданий
Слайд 25
Средний процент выполнения заданий