Слайд 2
Что такое оксиды?
Оксиды – это сложные
вещества, состоящие из двух элементов, один из которых кислород.
Общая формула:
ЕmOn
Слайд 4
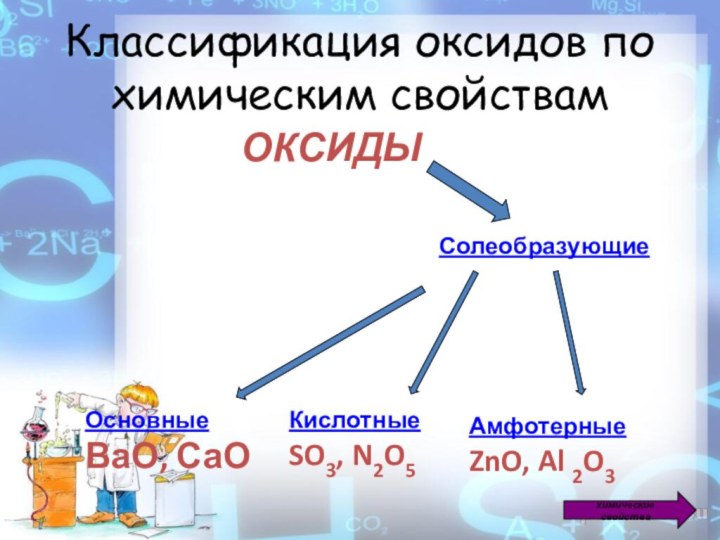
Классификация оксидов по химическим свойствам
ОКСИДЫ
Солеобразующие
Основные
ВаО, СаО
Кислотные
SO3,
N2O5
Амфотерные
ZnO, Al 2O3
химические свойства
Слайд 5
Названия оксидов
Оксид алюминия Al2O3
Оксид калия
K2O
Оксид бария
BaO
В случае, если элемент обладает переменной валентностью, то обязательно в скобках указывают валентность этого элемента в оксиде.
Оксид меди (II) СuO
Оксид серы (VI) SO3
Оксид углерода (IV) CO2
Слайд 6
Какие элементы образуют кислотные и основные оксиды?
Основные оксиды
образуют металлы, которые проявляют валентность I, II, III.
Примеры: Na2O,
MgO, CaO, CuO, K2O, FeO.
Кислотные оксиды образуют неметаллы и металлы, которые проявляют валентность VI, VII (например Мn2O7, СrO3).
SO2, P2O5, CO2, SiO2, N2O5
Слайд 7
Получение основных оксидов.
Взаимодействие металлов с кислородом (горение)
2Mg +
O2 = 2MgO
Слайд 8
Получение кислотных оксидов
Взаимодействие неметаллов с кислородом
(горение)
S + O2 = SO2
Слайд 9
Получение кислотных оксидов
Взаимодействие неметаллов с кислородом (горение)
4P +
5O2 =2P2O5
Слайд 10
Химические свойства основных оксидов
Взаимодействие с водой:
Правило: при взаимодействии
основных оксидов с водой образуются растворимые основания (щелочи).
Примеры: Li2O
+ H2O = 2LiOH
Na2O + H2O = 2NaOH
K2O + H2O = 2KOH
BaO + H2O = Ba(OH)2
CaO + H2O = Ca(OH)2
Слайд 11
Химические свойства основных оксидов
Обратите внимание! С водой взаимодействуют
только оксиды активных металлов (лития, натрия, калия, бария, кальция)!
Слайд 12
Химические свойства основных оксидов
Взаимодействие с кислотными оксидами:
Правило: при
взаимодействии основных оксидов с кислотными оксидами образуется соль.
Примеры: СаО
+ N2O5 = Ca(NO3)2
соль
Na2O + SO3 = Na2SO4
соль
Слайд 13
Как правильно составить соль?
Соль
Металл Кислотный остаток
Металл мы переписываем из основного оксида, а кислотный остаток - из соответствующей кислоты. Для этого нужно знать, какому кислотному оксиду какая кислота соответствует. Давайте разберемся…
Слайд 14
Как правильно составить соль?
Валентность кислотного остатка определяется
по
количеству атомов водорода в кислоте.
Слайд 15
Как правильно составить соль?
Итак, рассмотрим алгоритм действий и
составим соль в уравнении:
СаО + Р2О5 =
Выписываем металл
(Са) и рядом кислотный остаток, который соответствует вашему кислотному оксиду (РО4)
СаРО4
2. Подписываем валентности металла и кислотного остатка
II III
Ca PO4
3. Находим НОК и уравновешиваем левую и правую часть формулы соли: Са3(РО4)2
Слайд 16
Химические свойства основных оксидов
Взаимодействие с кислотами
Правило: При взаимодействии
основных оксидов с кислотами образуются соль и вода.
Примеры: ВаО
+ 2HNO3 = Ва(NO3)2 + H2O
соль
3K2O + 2H3PO4 = 2K3PO4 + 3H2O
соль
Слайд 17
Химические свойства кислотных оксидов
Взаимодействие с водой
Правило: При взаимодействии
кислотных оксидов с водой образуются кислоты (исключение составляет оксид
кремния SiO2 – речной песок не растворяется в воде)
Примеры: SO3 + H2O = H2SO4 (серная кислота)
СО2 + Н2О = Н2СО3 (угольная кислота)
Слайд 18
Химические свойства кислотных оксидов
2. Взаимодействие кислотных оксидов с
основными оксидами (см. выше)
3. Взаимодействие с растворимыми основаниями.
Правило: При
взаимодействии кислотных оксидов с растворимыми основаниями образуются соль и вода.
Слайд 19
Химические свойства кислотных оксидов
Примеры: SO2 + 2NaOH =
Na2SO3 + H2O
соль
P2O5 +3Ba(OH)2 = Ba3(PO4)2 +3H2O
соль
Слайд 20
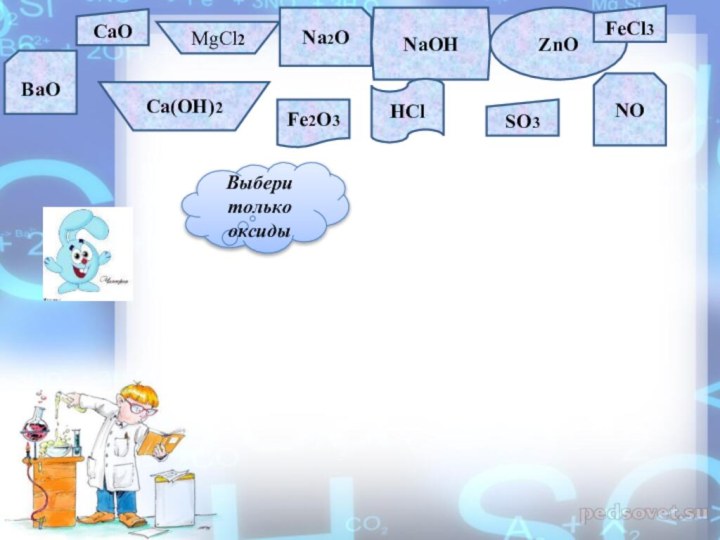
Закрепление пройденного материала
Слайд 22
CaO
MgCl2
Na2O
NaOH
ZnO
FeCl3
BaO
Ca(OH)2
Fe2O3
HCl
SO3
NO
Выбери только оксиды
Слайд 23
2. Составьте формулы оксидов элементов
Магния
Калия
Алюминия
Фосфора (V)
Хлора (VII )
Железа
(III)
Углерода (IV)
Серы (VI)
Выпишите в два столбика оксиды металлов и неметаллов.