Слайд 2
Цель работы
Дать понятие о химическом
и электронном строении бензола.
Ознакомиться с химическими
свойствами бензола, обусловленными его строением.
Углубить понятия о химических реакциях.
Выявление особенностей химических свойств гомологов по сравнению с бензолом как результат проявления взаимного влияния атомов в молекуле.
Развитие понятий гомологии и изомерии.
Слайд 3
Содержание
Ароматические углеводороды
Строение бензола
Физические свойства
Изомерия
Химические свойства аренов
Реакции
замещения
Реакции присоединения
Реакции окисления
Получение
Применение ароматических углеводородов
Литература
Слайд 4
Ароматические соединения (от греч. árômа
— благовоние), класс органических циклических соединений, все атомы которых
участвуют в образовании единой сопряжённой системы; p-электроны такой системы образуют устойчивую, т. е. замкнутую, электронную оболочку.
Название «Ароматические соединения» закрепилось вследствие того, что первые открытые и изученные представители этого класса веществ обладали приятным запахом.
Общая формула ароматических углеводородов CnH2n-6.
Слайд 5
Строение бензола
Бензол С6Н6
– родоначальник ароматических углеводородов. Каждый из шести атомов углерода
в его молекуле находится в состоянии sp2-гибридизации и связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы между каждой парой σ-связей равны 120°. Таким образом, скелет σ-связей представляет собой правильный шестиугольник, в котором все атомы углерода и все σ-связи С-С и С-Н лежат в одной плоскости:
Слайд 6
Строение бензола
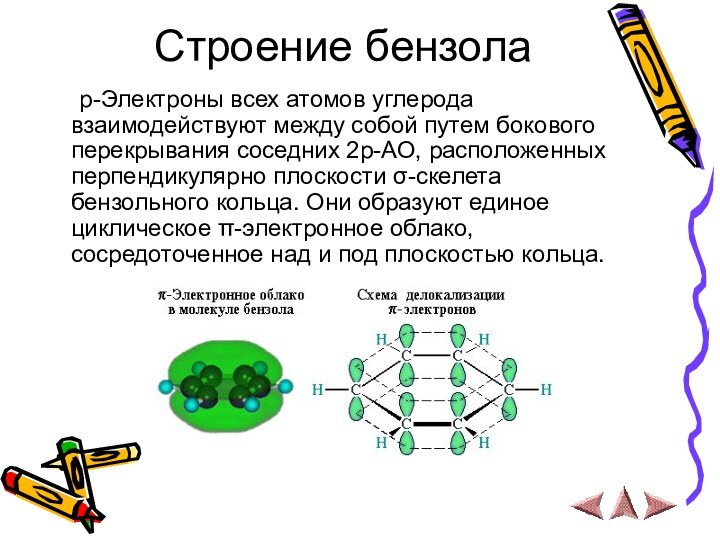
р-Электроны всех атомов углерода
взаимодействуют между собой путем бокового перекрывания соседних 2р-АО, расположенных
перпендикулярно плоскости σ-скелета бензольного кольца. Они образуют единое циклическое π-электронное облако, сосредоточенное над и под плоскостью кольца.
Слайд 7
Физические свойства:
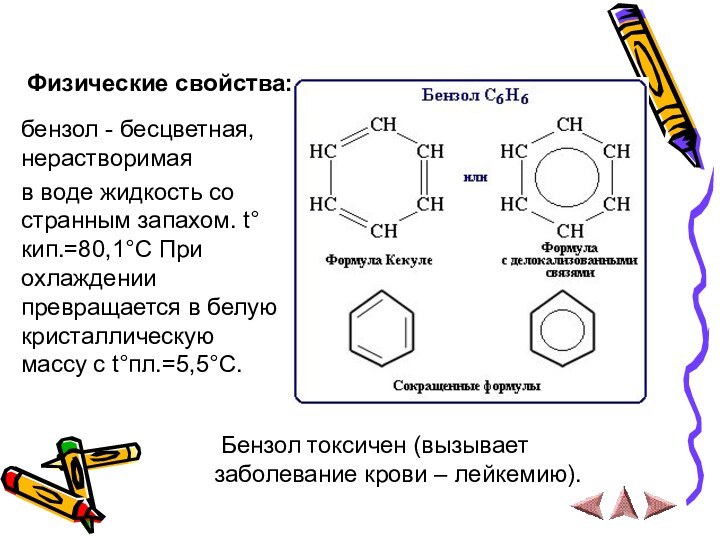
бензол - бесцветная, нерастворимая
в воде жидкость
со странным запахом. t°кип.=80,1°C При охлаждении превращается в белую
кристаллическую массу с t°пл.=5,5°C.
Бензол токсичен (вызывает заболевание крови – лейкемию).
Изомерия обусловлена изомерией углеродного скелета имеющихся радикалов и их
взаимным положением в бензольном кольце. Положение двух заместителей указывают с помощью приставок: орто- (о-), если они находятся у соседних углеродных атомов (положение 1, 2), мета- (м-) для разделенных одним атомом углерода (1, 3-) и пара- (п-) для находящихся напротив друг друга (1, 4-).
Например, для диметилбензола (ксилола)
Слайд 9
Химические свойства аренов
Бензольное ядро обладает
высокой прочностью, чем и объясняется склонность ароматических углеводородов к
реакциям замещения. В отличие от алканов, которые также склонны к реакциям замещения, ароматические углеводороды характеризуются большой подвижностью атомов водорода в ядре, поэтому реакции галогенирования, нитрования, сульфирования и др. протекают в значительно более мягких условиях, чем у алканов.
Слайд 10
Реакции замещения.
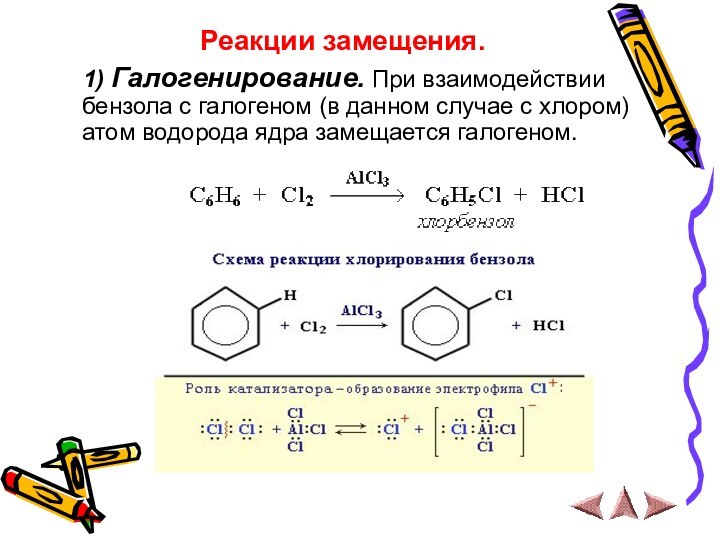
1) Галогенирование. При взаимодействии
бензола с галогеном (в данном случае с хлором) атом
водорода ядра замещается галогеном.
Слайд 11
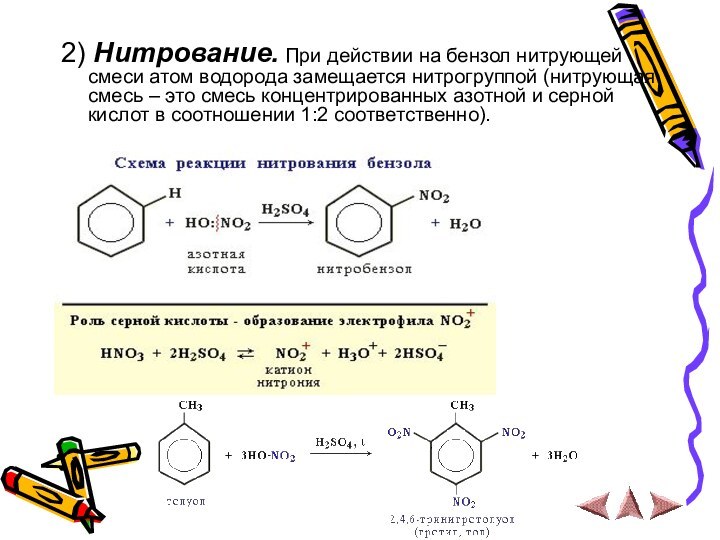
2) Нитрование. При действии на бензол нитрующей смеси
атом водорода замещается нитрогруппой (нитрующая смесь – это смесь
концентрированных азотной и серной кислот в соотношении 1:2 соответственно).
Слайд 12
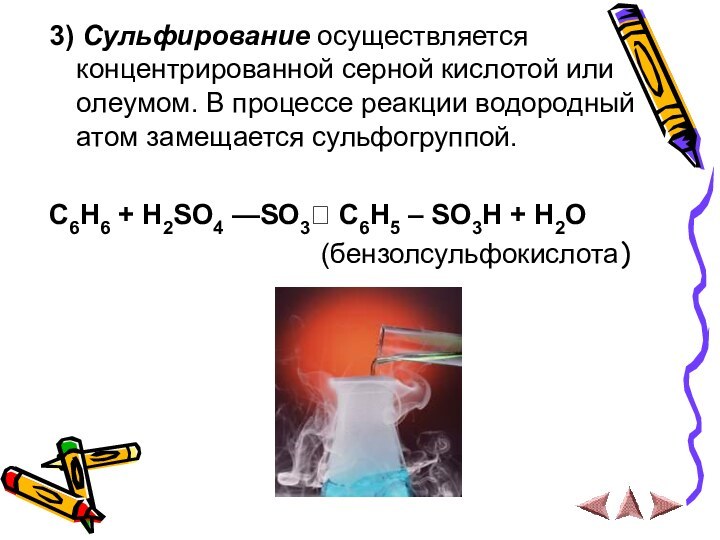
3) Сульфирование осуществляется концентрированной серной кислотой или олеумом. В
процессе реакции водородный атом замещается сульфогруппой.
C6H6 + H2SO4
—SO3? C6H5 – SO3H + H2O
(бензолсульфокислота)
Слайд 13
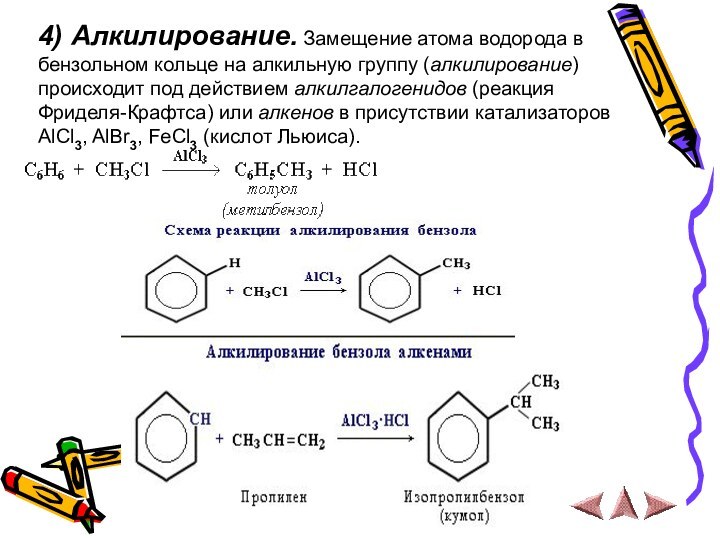
4) Алкилирование. Замещение атома водорода в
бензольном кольце на алкильную группу (алкилирование) происходит под действием
алкилгалогенидов (реакция Фриделя-Крафтса) или алкенов в присутствии катализаторов AlCl3, AlBr3, FeCl3 (кислот Льюиса).
Слайд 14
Несмотря на склонность бензола к реакциям
замещения, он в жестких условиях вступает и в реакции
присоединения.
Реакции присоединения.
5) Гидрирование. Присоединение водорода осуществляется только в присутствии катализаторов и при повышенной температуре. Бензол гидрируется с образованием циклогексана, а производные бензола дают производные циклогексана.
Слайд 15
6) Галогенирование. Радикальное хлорирование
В условиях радикальных реакций
(ультрафиолетовый свет, повышенная температура) возможно присоединение галогенов к ароматическим
соединениям. При радикальном хлорировании бензола получен "гексахлоран" (средство борьбы с вредными насекомыми).
Слайд 16
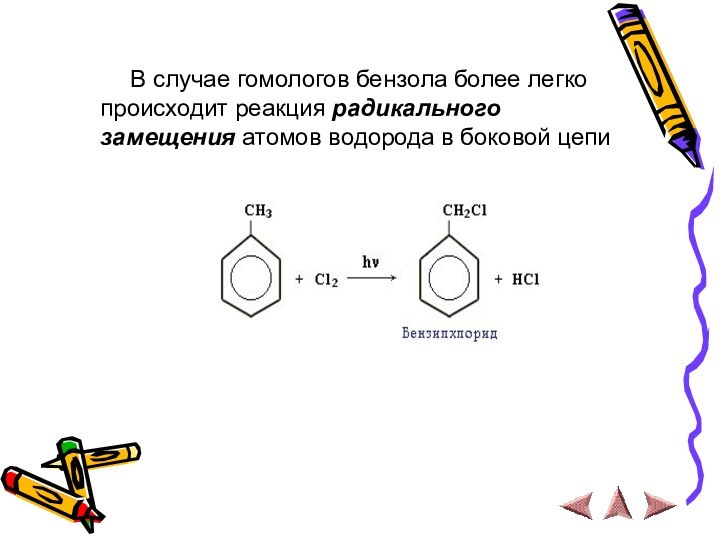
В случае гомологов бензола более
легко происходит реакция радикального замещения атомов водорода в боковой
цепи
Слайд 17
Запомните
Если в молекуле бензола
один из атомов водорода замещен на углеводородный радикал, то
в дальнейшем в первую очередь будут замещаться атомы водорода при втором, четвертом и шестом атомах углерода.
Слайд 18
Реакции окисления.
7) Толуол, в отличие
от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор
KMnO4 при нагревании):
В толуоле окисляется не бензольное кольцо, а метильный радикал.
8) Горение.
2C6H6 + 15O2?12CO2 + 6H2O (коптящее пламя).
Слайд 19
1) Каталитическая дегидроциклизация алканов, т.е. отщепление водорода с
одновременной циклизацией (способ Б.А.Казанского и А.Ф.Платэ). Реакция осуществляется при
повышенной температуре с использованием катализатора, например оксида хрома
C7H16 ––500°C→ C6H5 – CH3 + 4H2
2) Каталитическое дегидрирование циклогексана и его производных (Н.Д.Зелинский). В качестве катализатора используется палладиевая чернь или платина при 300°C.
C6H12 ––300°C,Pd→ C6H6 + 3H2
Получение
Слайд 20
3) Циклическая тримеризация ацетилена и его гомологов над активированным
углем при 600°C (Н.Д.Зелинский).
3C2H2 ––600°C→ C6H6
4) Сплавление солей ароматических кислот
со щелочью или натронной известью.
C6H5-COONa + NaOH ––t°→ C6H6 + Na2CO3
5) Алкилирование собственно бензола галогенопроизводными (реакция Фриделя-Крафтса) или олефинами.
C6H6 + CH3Cl ––AlCl3→ C6H5 – CH3 + HCl
C6H6 + CH2 = CH2 ––H3PO4→ C6H5–CH2–CH3
Слайд 21
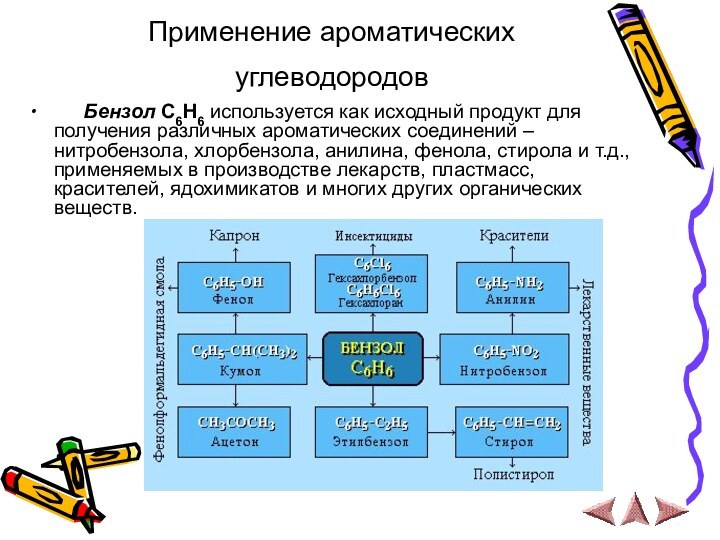
Применение ароматических углеводородов
Бензол С6Н6
используется как исходный продукт для получения различных ароматических соединений
– нитробензола, хлорбензола, анилина, фенола, стирола и т.д., применяемых в производстве лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ.
Слайд 22
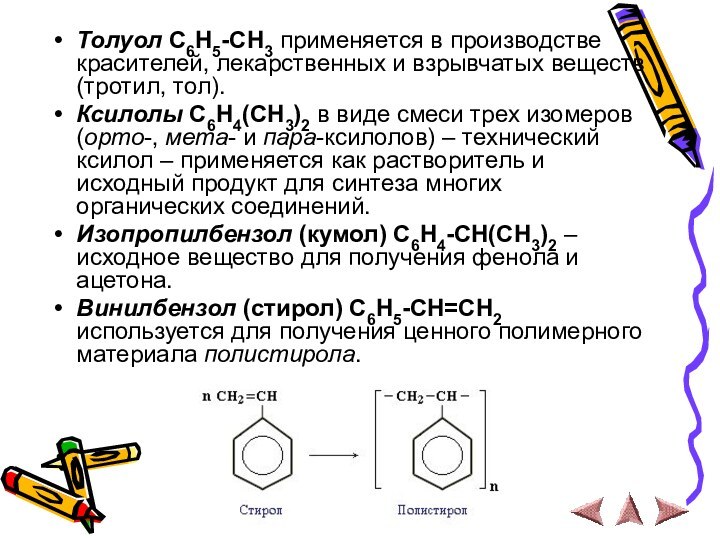
Толуол С6Н5-СН3 применяется в производстве красителей, лекарственных и
взрывчатых веществ (тротил, тол).
Ксилолы С6Н4(СН3)2 в виде смеси трех
изомеров (орто-, мета- и пара-ксилолов) – технический ксилол – применяется как растворитель и исходный продукт для синтеза многих органических соединений.
Изопропилбензол (кумол) С6Н4-СН(СН3)2 – исходное вещество для получения фенола и ацетона.
Винилбензол (стирол) C6H5-CН=СН2 используется для получения ценного полимерного материала полистирола.
Слайд 23
Литература
1. Петров А.А., Бальян Х.В., Трощенко
А.Т.
Органическая химия. Учебник для вузов./ Под
ред. Петрова
А.А. – М.: Высшая школа, 1981.
2. Хомченко Г.П. Пособие по химии для
поступающих в вузы. – М.: ООО «Издательство
Новая Волна», 2002.
3. Курмашева К.К. Химия в таблицах и схемах.
Серия «Школа в клеточку». – М.: «Лист», 1997.
4. Потапов В.М., Чертков И.Н. Строение и
свойства органических веществ. Пособие для
учащихся 10 кл. – М.: Просвещение, 1980.
Слайд 24
5. Оганесян Э.Т. Руководство по
химии
поступающим в вузы. Справочное пособие. – М.:
Высшая школа,1991.
6. Иванова Р.Г., Осокина Г.Н. Изучение
химии в 9-10 классах. Книга для учителя. – М.:
Просвещение, 1983.
7. Денисов В.Г. Химия. 10 класс. Поурочные
планы. – Волгоград: Учитель, 2004.
8. Аргишева А.И., Задумина Э.А. Химия:
Подготовка к государственному
централизованному тестированию. – Саратов:
Лицей, 2002.