- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Арены. Бензол
Содержание
- 2. Майкл Фарадей (1791 - 1867) Английский физик
- 3. Фридрих Август Кекуле 1829 - 1896Немецкий химик-органик.
- 5. Образование σ-связей в молекуле бензолаАтомы углерода в
- 6. Образование π-системы в молекуле бензола Каждый атом
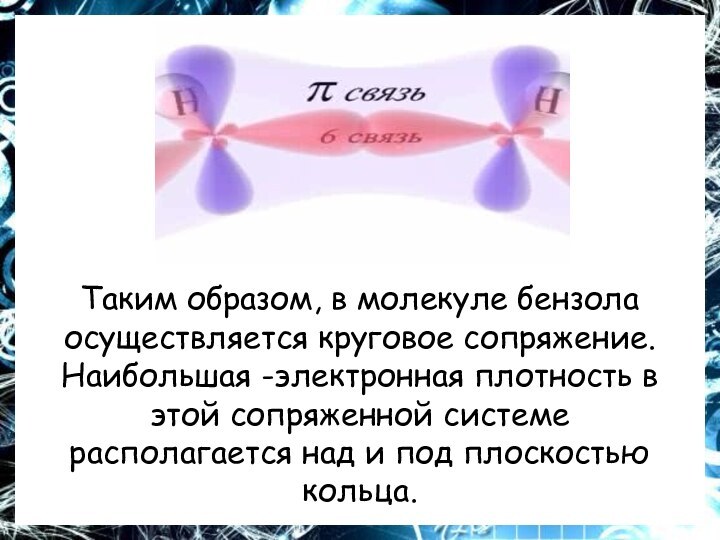
- 7. Таким образом, в молекуле бензола осуществляется круговое
- 8. Словарь Ароматические углеводороды (арены) – это углеводороды
- 9. Виды ароматических углеводородов
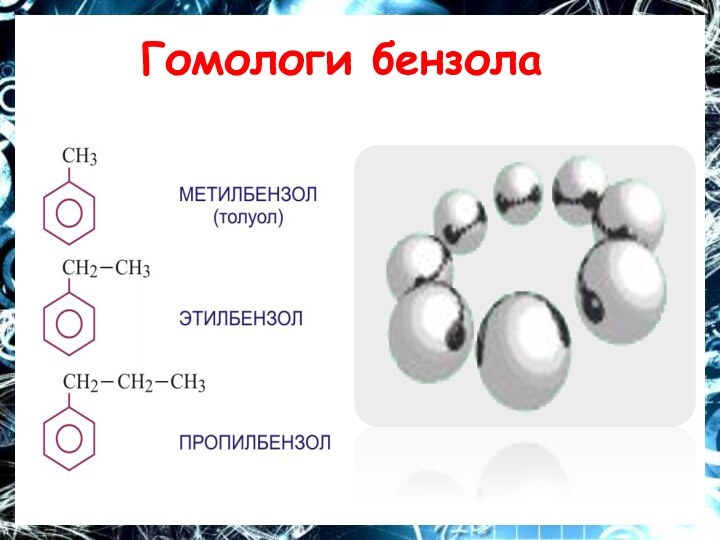
- 10. Гомологи бензола
- 11. Номенклатура аренов
- 12. Физические свойстваБензол – бесцветная, летучая, огнеопасная жидкость
- 13. Химические свойстваРеакции окисленияГорение
- 14. Химические свойстваРеакции окисленияМягкое окислениеБензол не обесцвечивает раствор перманганата калия
- 15. Химические свойстваРеакции присоединенияГидрирование
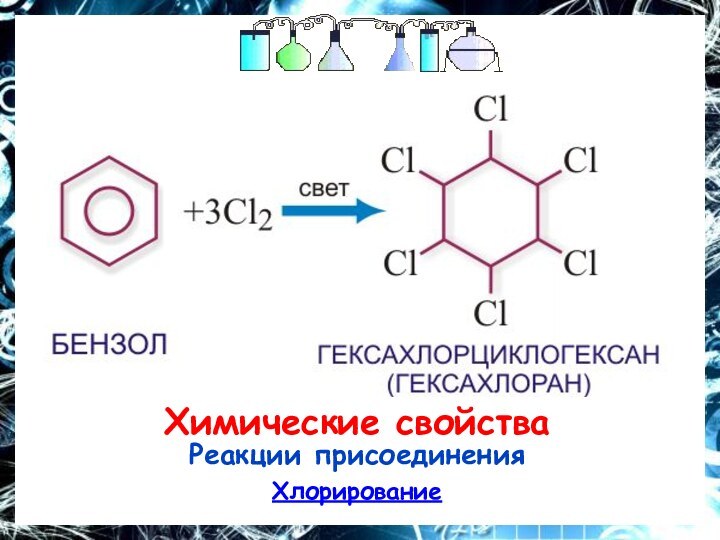
- 16. Химические свойстваРеакции присоединенияХлорирование
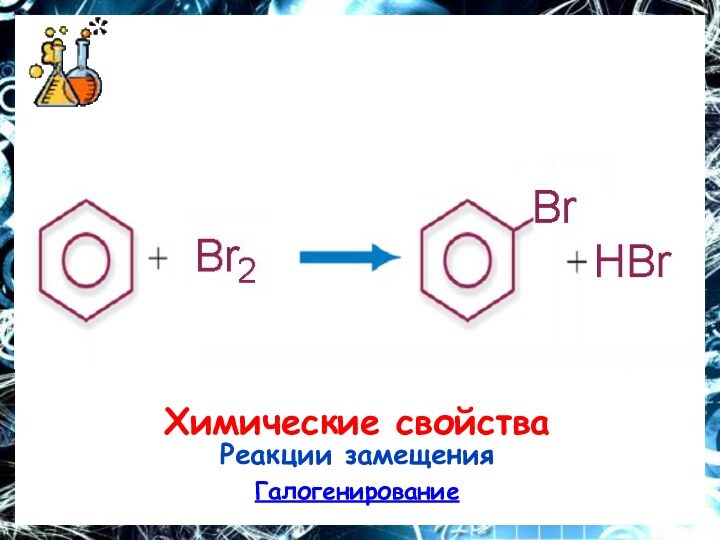
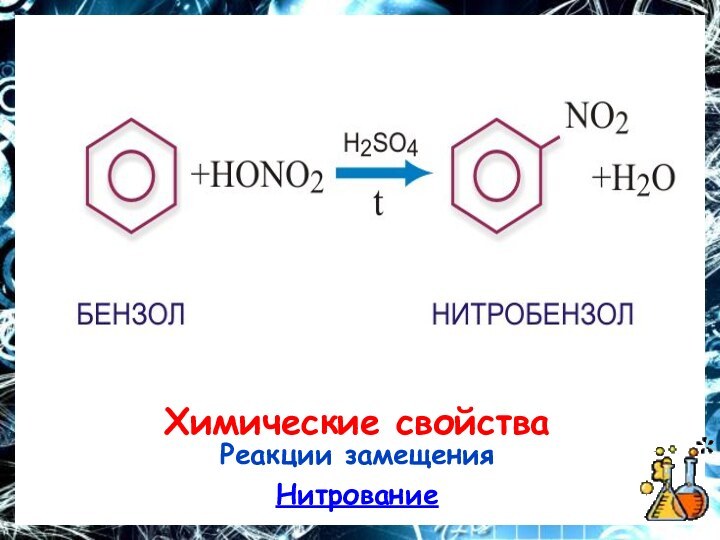
- 17. Химические свойстваРеакции замещенияГалогенирование
- 18. Скачать презентацию
- 19. Похожие презентации
Майкл Фарадей (1791 - 1867) Английский физик и химик, член Лондонского королевского общества. В 1823 г. впервые получил жидкие хлор, сероводород, оксид углерода(IV), аммиак, оксид азота(IV). В 1825 г. открыл бензол, изучил его физические и некоторые












Слайд 3
Фридрих Август Кекуле
1829 - 1896
Немецкий химик-органик. Предложил структурную
формулу молекулы бензола. С целью проверки гипотезы о равноценности
всех шести атомов водорода в молекуле бензола получил его галоген-, нитро-, амино-, и карбоксипроизводные.
Слайд 5
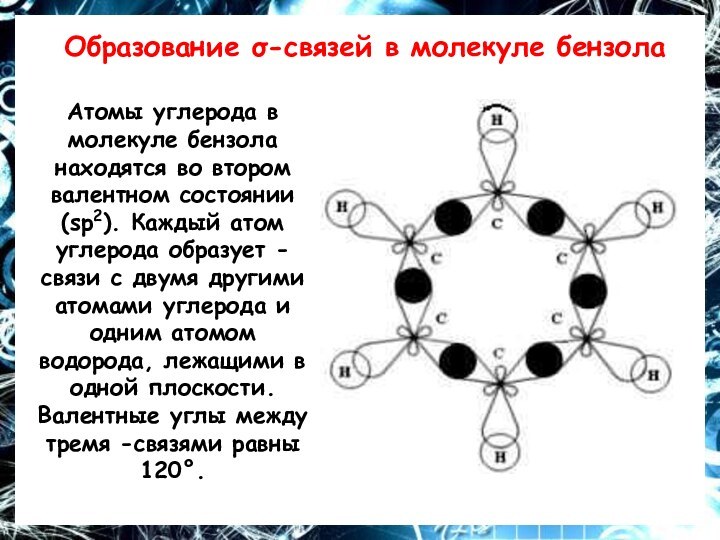
Образование σ-связей в молекуле бензола
Атомы углерода в молекуле
бензола находятся во втором валентном состоянии (sp2). Каждый атом
углерода образует -связи с двумя другими атомами углерода и одним атомом водорода, лежащими в одной плоскости. Валентные углы между тремя -связями равны 120°.
Слайд 6
Образование π-системы в молекуле бензола
Каждый атом углерода
имеет одну негибридную р-орбиталь. Шесть таких орбиталей располагаются перпендикулярно
плоскости связей и параллельно друг другу. Все шестьр-электронов взаимодействуют между собой, образуя единое -электронное облако.





























