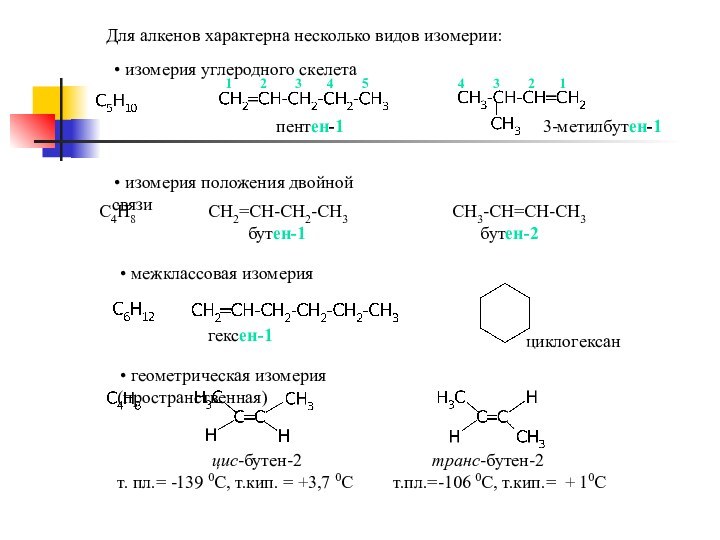
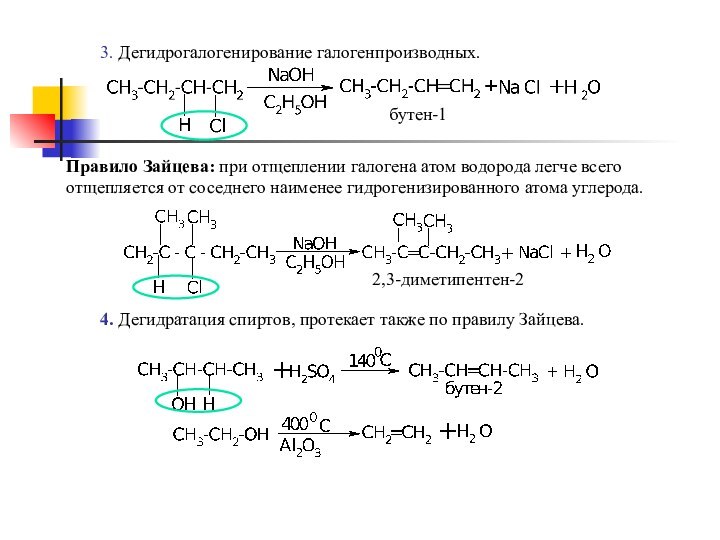
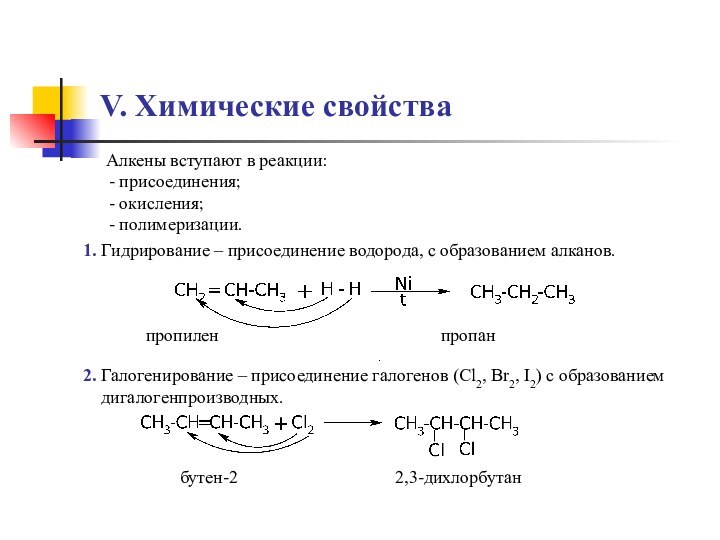
sp2-гибридизации,
состоящей из 3 sp-гибридизованных орбиталей
и 1 p-орбиталиПростейший представитель этого класса – этилен СН2=СН2
плоскость π-связи
плоскость σ-связи
σ-Связи С-С и С-Н находятся в одной плоскости
под углом 120 0 друг к другу,
π-связь перпендикулярна плоскости σ-связи.
Характеристика π-связи С=С:
энергия (σ – π) 587 кДж/моль
длина 0,134 нм
валентный угол 120 0
энергия π 235 кДж/моль