- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Атом
Содержание
- 2. Атомы химических элементов Содержание:Основные сведения о строении атомов:Доказательства сложности строения атомаСостав атомаСостав атомного ядраТренировочные заданияЛитература
- 3. Демокрит (460–371 гг. н.э.) Древнегреческий ученый, философ-материалист. Ученик
- 5. Дальтон Джон (1766–1844) Английский химик и физик,
- 6. Томсон Джон Паджет (1892–1975) Английский физик, в
- 7. Резерфорд Эрнст (1871–1937) Английский физик, с 1903 г.
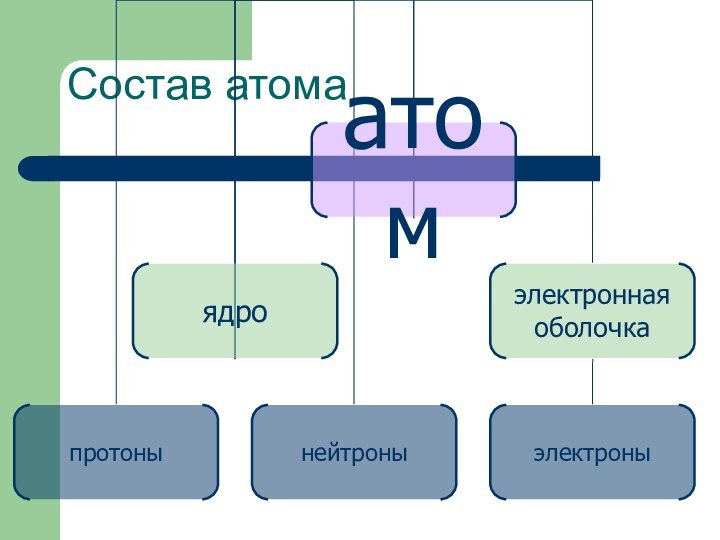
- 9. Состав атома
- 10. Размер атомов Атом имеет очень малые размеры,
- 11. Состав атома Все известные химические элементы приведены
- 12. Атомное ядро Практически вся масса атома (более
- 13. Ядро
- 14. Электроны Все вещества электронейтральны. Атомы – составные части
- 15. Движение электрона в атоме Электроны в атоме
- 16. Все известные химические элементы приведены в таблице
- 17. Задание №1 Определите состав атома элемента номер:1вариант
- 18. Алгоритм1.Выберите элемент в ПСХЭ и запишите его
- 19. Задание №2 1.Откройте ОК «Химия, 8 кл.»;
- 20. Скачать презентацию
- 21. Похожие презентации
Атомы химических элементов Содержание:Основные сведения о строении атомов:Доказательства сложности строения атомаСостав атомаСостав атомного ядраТренировочные заданияЛитература


















Слайд 2
Атомы химических элементов
Содержание:
Основные сведения о строении атомов:
Доказательства сложности
строения атома
Слайд 3
Демокрит (460–371 гг. н.э.)
Древнегреческий ученый, философ-материалист. Ученик Левкиппа. Родился
в Абдере (Фракия).
Сочинения Демокрита по всем отраслям науки того
времени создали ему славу крупнейшего представителя древней атомистики. Признавал вечность материи и считал, что она состоит из бесконечного числа мельчайших неделимых частиц – атомов, различное сочетание которых образует бесчисленное множество разнообразных вещей и их свойств. Утверждал, что атомы движутся под влиянием господства необходимости.Слайд 4 Ломоносов Михаил Васильевич
(1711–1765)
Русский ученый, с 1745 г.
академик Петербургской АН. Изложил в 1741–1750 гг. основы атомно-корпускулярного учения; выдвинул в 1744–1748 гг. кинетическую теорию теплоты; обосновал в 1747–1752 гг. необходимость привлечения физики для объяснения химических явлений
Слайд 5
Дальтон Джон (1766–1844)
Английский химик и физик, с 1822 г.
член Лондонского королевского общества. Родился в Иглсфилде (Кумберленд). Образование
получил самостоятельно. В период с 1781 по 1793 гг. учитель математики в школе в Кендале, с 1793 г. преподавал физику и математику в Новом колледже в Манчестере.
Слайд 6
Томсон Джон Паджет (1892–1975)
Английский физик, в 1930 г. член
Лондонского королевского общества. Родился в Кембридже. В 1914 г. окончил
Кембриджский университет, там же работал в 1919–1922 гг. В 1922–1930 гг. – профессор Абердинского университета (Шотландия), в 1952–1962 гг. возглавлял один из колледжей в Кембридже.Работы относятся к атомной и ядерной физике, квантовой механике, аэродинамике, электрическим разрядам в газах. В 1927 г. открыл явление дифракции электронов. Осуществил исследования по геометрии электронограмм, теории рассеяния.
Награжден медалями Д. Юза в 1939 г., Королевской в 1949 г., М. Фарадея в 1960 г. Лауреат Нобелевской премии в 1937 г.
Слайд 7
Резерфорд Эрнст (1871–1937)
Английский физик, с 1903 г. член Лондонского
королевского общества, его президент в 1925–1930 гг. Родился в Спринг-Броуве
(ныне Брайтуотер) в Новой Зеландии. В 1894 г. окончил Кентерберийский колледж Новозеландского университета в Крайстчерче. В 1895–1898 гг. работал в Кавендишской лаборатории Кембриджского университета под руководством физика Дж. Дж. Томсона, 1898–1907 гг. профессор Мак-Гиллского университета в Монреале (Канада), в 1907–1919 гг. Манчестерского университета. С 1919 г. профессор Кембриджского университета и директор Кавендишской лаборатории.Один из основателей учения о радиоактивности, ядерной физики и представлений о строении атомов.
Слайд 8
Наименьшая электронейтральная частица химического
элемента, являющаяся носителем его свойств.Атом
Слайд 10
Размер атомов
Атом имеет очень малые размеры, порядка долей
нанометра
1 нм = 10-9мРазмеры атомов в твердом или жидком веществе можно рассчитать, зная плотность вещества r, из которой может быть найден молярный объем вещества
Vм = M/r
и вычислен объем, приходящийся на один атом
Vатом = Vм/Nа
Например, радиус атома железа составляет 0,13 нм.
Слайд 11
Состав атома
Все известные химические элементы приведены в таблице
Д. И. Менделеева. В ней они располагаются в порядке
возрастания зарядов их атомных ядер.Поскольку каждый атом электронейтрален, то число протонов в ядре атома равно числу электронов в этом же атоме.
Тем самым порядковый номер элемента в таблице Менделеева указывает число электронов в атоме и равное ему число протонов в ядре.
Принадлежность атома тому или иному химическому элементу определяется зарядом его ядра. Поэтому число протонов, составляющих заряд ядра, у атомов одного и того же химического элемента строго определенное. В то же время содержание нейтронов в ядрах одного и того же элемента может быть переменным.
Следовательно, массы атомов одного элемента могут быть различными. Эти различные виды атомов одного химического элемента называются изотопами (от "изо" – равный и "топос" – место), так как они занимают одно место в таблице Д. И. Менделеева, поскольку принадлежат одному элементу.
Приведенные в таблице Д. И. Менделеева атомные массы элементов – это средние атомные массы природной смеси изотопов данного элемента с учетом их относительного содержания в природе, поэтому они могут отличаться от целых чисел.
Напомним, что атомная единица массы – это 1/12 массы атома углерода, причем того его изотопа, в ядре которого находится 6 протонов и 6 нейтронов.
Слайд 12
Атомное ядро
Практически вся масса атома (более 99,95%) сосредоточена
в очень малом объеме – в ядре атома, находящемся в
его центре. Диаметр ядра, если считать его шарообразным, составляет приблизительно одну стотысячную часть от диаметра атома.Ядра атомов имеют сложное строение. Они состоят из двух видов частиц с почти одинаковой массой, практически равной 1 а. е. м., электронейтральных нейтронов и положительно заряженных протонов, причем положительный заряд протона – наименьший существующий в природе электрический заряд, т. е. элементарный, который далее неделим. Заряд протона принимают за 1.
Таким образом, ядра атомов заряжены положительно, их заряд численно равен числу протонов, а массы ядер, следовательно и массы атомов, выраженные в атомных единицах массы, близки к целым числам.
Слайд 14
Электроны
Все вещества электронейтральны. Атомы – составные части вещества, следовательно,
атомы в целом должны быть нейтральны. В состав атома,
кроме положительно заряженного ядра, входят отрицательно заряженные частицы – электроны.Электрический заряд электрона (отрицательный) численно равен заряду протона (положительному). Ясно поэтому, что в нейтральном атоме число электронов равно числу протонов в его ядре. Таким образом, атом состоит из очень маленького, но тяжелого положительно заряженного ядра, в состав которого входят протоны и нейтроны. Около ядра движутся еще меньшие отрицательно заряженные электроны. (Масса электрона равна приблизительно 1/2000 а. е. м., т. е. электрон приблизительно в 2000 раз легче протона или нейтрона.)
Слайд 15
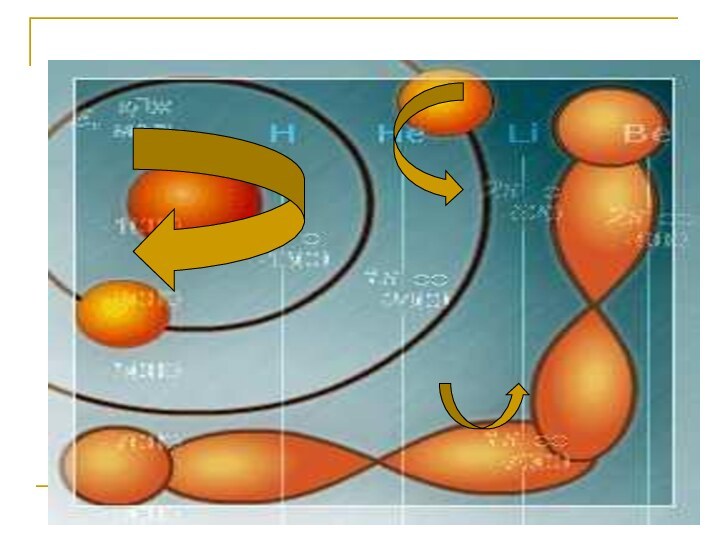
Движение электрона в атоме
Электроны в атоме не
могут быть неподвижными. Если бы электрон был неподвижным, то
под действием силы притяжения к положительно заряженному ядру он немедленно упал бы на ядро. Но электрон и не вращается вокруг ядра. Движение электрона, как и других частиц субатомных размеров (т. е. размеров, меньших атомных), описывается законами квантовой механики.Законы квантовой механики, которым подчиняется движение электрона, указывают (причем точно) вероятность его нахождения в том или другом месте пространства. В одних местах его можно обнаружить чаще, и мы говорим о большей вероятности его нахождения в них, в других – реже, значит, имеется меньшая вероятность застать его там, в третьих он не бывает никогда, тогда говорят о нулевой вероятности.
Соответственно говорят о повышенной или пониженной электронной плотности в разных областях пространства около атомного ядра.
Об электроне, движущемся в этой области пространства, будем говорить, что он "находится на этой орбитали". Согласно законам квантовой механики на одной орбитали может находиться не более двух электронов.
Слайд 16 Все известные химические элементы приведены в таблице Д.
И. Менделеева. В ней они располагаются в порядке возрастания
зарядов их атомных ядер.Поскольку каждый атом электронейтрален, то число протонов в ядре атома равно числу электронов в этом же атоме.
Тем самым порядковый номер элемента в таблице Менделеева указывает число электронов в атоме и равное ему число протонов в ядре.
Принадлежность атома тому или иному химическому элементу определяется зарядом его ядра. Поэтому число протонов, составляющих заряд ядра, у атомов одного и того же химического элемента строго определенное.
ЗАПОМНИТЕ :
Слайд 17
Задание №1
Определите состав атома элемента номер:
1вариант
2
вариант6 1)17
18 (Ar, Ar, Ar) 2)19 (К, К, К)
35 3)56
Слайд 18
Алгоритм
1.Выберите элемент в ПСХЭ и запишите его знак
2.Запишите
атомный номер элемента Z и его массовое число А
3.Запишите
значение Z слева внизу и значение А слева вверху у знака элемента4.Определите состав атома:
число протонов
число электронов
число нейтронов
5.Запишите состав атома
6.Сделайте вывод
Бор В
Z=5
А=11
В
N (р)=5
N (е)=5
N (n)=11-5=6
В (5р, 6n )5е
Ядро атома бора состоит из пяти протонов и шести нейтронов, а электронная оболочка- из пяти электронов
Слайд 19
Задание №2
1.Откройте ОК «Химия, 8 кл.»;
2.компонент
«Курсы»;
3.закладка «Учебники»;
4.Габриелян О.С., глава
1, основные сведения о строении атомов;5.Состав атома. Тренажер;
6.выполните тест.





























