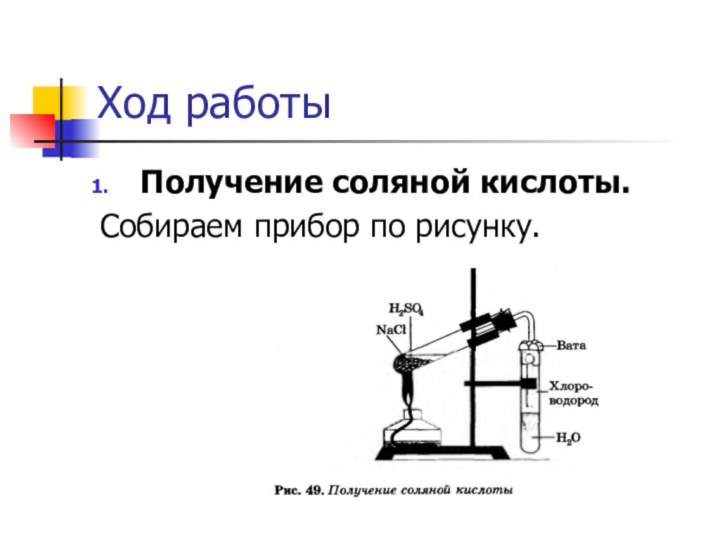
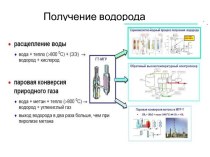
растворами.
Наливать или насыпать вещества можно только над столом или
специальным подносом. Для опыта брать только указанное количество вещества.Нельзя ошибочно взятый излишек реактива ссыпать (выливать) обратно в склянку или банку.
Все работы, связанные с выделением вредных газов или паров, проводить только в вытяжном шкафу при исправной вентиляции.
Твердые сыпучие реактивы можно брать только совочками, шпателями, но не руками. Измельчение твердых веществ разрешается проводить только в ступке с помощью пестика.
Обо всех случаях разлива жидкостей, а также о рассыпанных твердых реактивах нужно сообщить учителю. Место разлива следует обработать нейтрализующим раствором, а затем промыть водой.