е л и ч и в а ю т
с яУ в е л и ч и в а ю т с я
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть

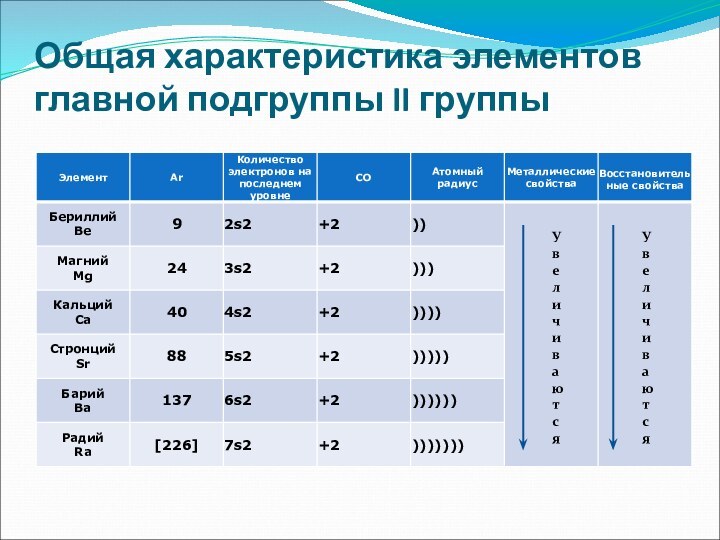












У в е л и ч и в а ю т с я