Слайд 3
Натрий, химические свойства
Электронная формула: 11Na 1s22s22p63s1; c.o.+1,
комплексообразование не характерно.
2Na+Cl2=2NaCl
хлорид натрия
2Na+S=Na2S
сульфид натрия
2Na+H2=2NaH
гидрид натрия
2Na+2H2O=2NaOH+H2
гидроксид натрия, водорастворимое
основание, щелочь
2Na+O2=Na2O2
пероксид натрия
Слайд 4
Натрий, химические свойства
Для регенерации воздуха в замкнутых помещениях
используется реакция:
2Na2O2+2CO2=2Na2CO3+O2
Na2O2+Na=2Na2O
оксид натрия, основный оксид
Na2O+H2O=2NaOH
NaOH+HCl=NaCl+H2O
2NaOH+H2SO4=Na2SO4+2H2O
сульфат натрия
NaOH+CO2=NaHCO3
гидрокарбонат
натрия, кислая соль, “питьевая сода”
Слайд 5
Топография
(Na) в организме=0,08%, макроэлемент, при массе тела
70 кг масса натрия 60г.
Топография натрия: Na+- основной внеклеточный
ион, распространен по всему организму, содержится в сыворотке крови, спинномозговой жидкости, в глазной жидкости, в пищеварительных соках, желчи, почках, коже, костной ткани, легких, мозге в виде растворимых солей NaCl, NaH2PO4, Na2HPO4, NaHCO3.
Слайд 6
Биороль натрия:
1. Поддерживает постоянное осмотическое давление в 7,7
атм. (осмотический гомеостаз).
2. Поддерживает постоянное значение pH биожидкостей (кислотно-основный
гомеостаз), т.к. входит в состав фосфатной и гидрокарбонатной буферных систем.
3. Участвует в регуляции водного обмена: 1г NaCl связывает 100мл воды.
4. Активирует ферменты.
5. Вместе с ионами K+, Ca2+, Mg2+, Cl- участвует в передаче нервных импульсов через мембраны нервных клеток, поддерживает нормальную возбудимость мышечных клеток.
6. NaCl -основной источник желудочного сока:
H2CO3+ Cl-= HCO3- + HCl
кровь NaCl кровь желудок
7. Ионы Na+ транспортируют CO2, сахара, аминокислоты через мембраны.
8. Ионы Na+ и K+ участвуют в механизме кратковременной памяти.
Слайд 7
Избыток и дефицит Na:
Избыток Na+ в клетках головного
мозга угнетает ЦНС, вызывает депрессию.
Недостаток Na+ ведёт к отёку
клеток головного мозга, судорогам, торможению развития организма.
Суточная потребность –1г. В организм Na+ поступает в виде NaCl, избыток NaCl приводит к развитию гипертонии, атеросклерозу, нарушению деятельности почек. Недостаток губителен, т.к. Na+ участвует в проведении нервных импульсов.
Слайд 8
Лекарственные препараты:
1. NaCl - 0,9%-ный раствор, физиологический раствор,
изотонический раствор. Внутривенно при интоксикациях и обезвоживании, для промывания
ран, для растворения лекарственных препаратов.
2. NaCl – 3-5-10%-ный раствор, гипертонический раствор. Наружно в компрессах для лечения гнойных ран. В результате осмоса происходит отделение гноя из раны и плазмолиз бактерий.
При отравлении солями серебра:
Ag++NaClAgCl+Na+
нерастворим, нетоксичен
3. NaHCO3-питьевая сода:
а) 4%-й раствор внутривенно при ацидозе:
NaHCO3+RCOOH=RCOONa+H2O+CO2
с мочой через легкие
Слайд 9
Лекарственные препараты:
б) при повышенной кислотности желудочного сока:
NaHCO3+HCl=NaCl+H2O+CO2
в) слабый
антисептик, т.к. в результате гидролиза растворы питьевой соды имеют
щелочную реакцию среды:
NaHCO3+H2OH2CO3+NaOH,
а щелочи губительно действуют на микробные клетки, осаждая клеточные белки.
4. Na2SO4 - слабительное средство, сульфат натрия плохо всасывается в кишечнике осмотическое давление в кишечнике увеличивается, жидкость через стенки поступает в просвет кишечника, его содержимое разжижается и выводится.
Слайд 10
Калий
Электронная формула:
19К 1s22s22p63s23p64s1, с.о.=+1, комплексообразование не характерно.
(К)
в организме=0,23%, макроэлемент, масса калия в организме 160г.
К+ -
основной внутриклеточный катион, 98% калия содержится во внутриклеточных жидкостях.
Топография: калий распространен по всему организму, находится во всех органах и тканях.
Слайд 11
Биороль К:
Участвует в сокращении мышц, способствует мышечному расслаблению.
Участвует
в проведении нервных импульсов (совместно с Na+, Ca2+, Mg2+,
Cl-).
Поддерживает нормальное функционирование сердца: уменьшает силу сокращения сердечной мышцы (антагонизм с Са2+).
Участвует в обменных процессах как активатор внутриклеточных ферментов в синтезе белка, окислении углеводов.
В эритроцитах ионы K+ участвуют в работе гемоглобиновой и оксигемоглобиновой буферных систем.
Слайд 12
Избыток и недостаток:
Избыток K+ ведет к снижению содержания
Na+, внеклеточная среда становится гипотонической и происходит гемолиз эритроцитов.
Также избыток K+ угнетает сокращения миокарда. При повышенном содержании К+ в клетках коры головного мозга происходит возбуждение ЦНС, возникает маниакальное состояние.
Недостаток K+ ведёт к аритмии, мышечной слабости, утомляемости.
Калий содержится в сухом молоке, растительной пище: картофеле, моркови, орехах, клюкве, чае, семечках, сухофруктах.
Суточная потребность 2-3 г.
Слайд 14
Лекарственные препараты:
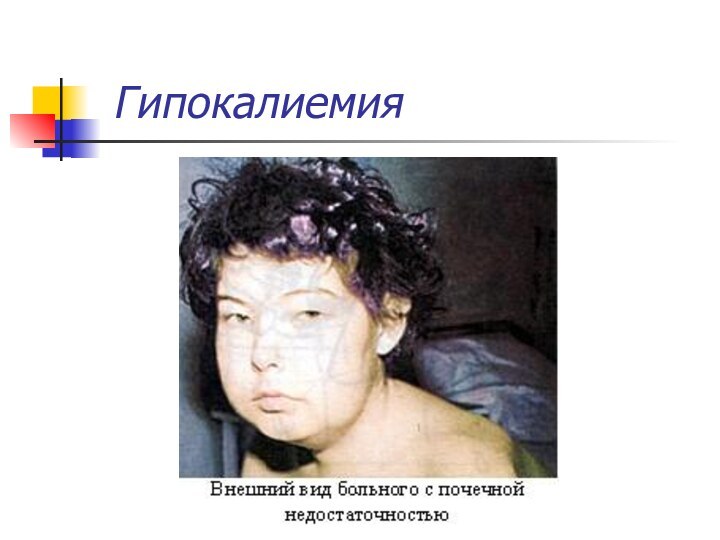
KCl – при гипокалиемии, аритмии, рвоте.
KI –
при эндемическом зобе.
KMnO4 – сильный окислитель, антисептик, наружно для
промывания ран.
KВr – при неврастении, неврозах, бессоннице.
Слайд 15
Кальций
Электронная формула:
20Ca 1s22s22p63s23p64s2, с.о.=+2, координационное число в
комплексных соединений 6,7,8. Кальций образует несимметричные комплексы с различными
биолигандами, может служить «мостиком» в межклеточном пространстве.
Слайд 16
Химические свойства:
Ca+S=CaS
сульфид кальция
Ca+Cl2=CaCl2
хлорид кальция
3Ca+N2=Ca3N2
нитрид кальция
Ca+H2=CaH2
гидрид кальция
Ca+2H2O=Ca(OH)2+H2
гидроксид кальция, основание
2Ca+O2=2CaO
оксид кальция, основный оксид
Слайд 17
Химические свойства:
CaO+CO2=CaCO3
карбонат кальция, мел
CaO+H2O=Ca(OH)2
Ca(OH)2+2CO2=Ca(HCO3)2
гидрокарбонат кальция
Ca(HCO3)2CaCO3+H2O+CO2
Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+H2SO4=CaSO4+2H2O
сульфат кальция
Слайд 18
Са in vivo
ω (Ca) в организме = 1,
4%, макроэлемент, масса кальция ~ 1,5 кг.
Топография: костная и
зубная ткань: сердце, кровь, почки, печень.
Ca2+ - внеклеточный ион.
Слайд 19
Биороль кальция:
1. Является основным минеральным компонентом костной и
зубной ткани в виде гидроксил- и фторапатитов (3Ca3(PO4)2 .
Ca(OH)2 и 3Ca3(PO4)2 . CaF2).
2. Регулирует работу сердца: увеличивает силу сокращения сердечной мышцы.
3. Участвует в свёртываемости крови, способствует агрегации тромбоцитов.
4. Участвует в сокращении мышц и передаче нервных импульсов.
5. Ионы Ca2+ понижают возбудимость ЦНС.
6. Обладает противовоспалительным и антиаллергическим действием.
Слайд 20
Избыток и недостаток:
Суточная потребность ~ 1г.
При недостатке
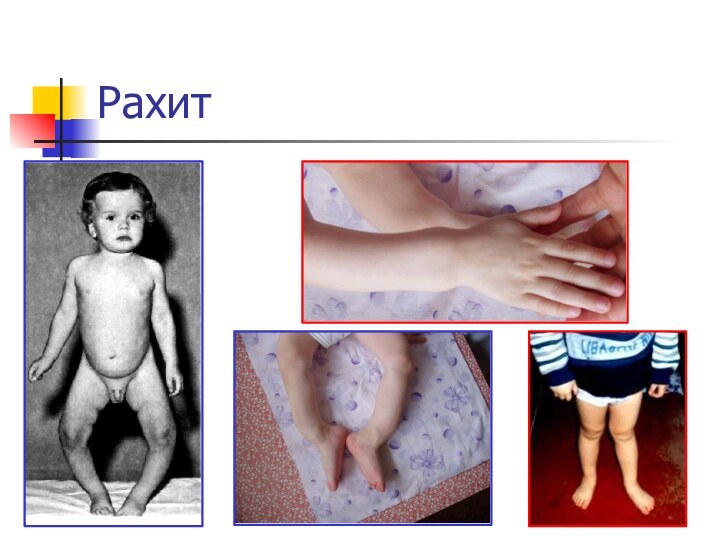
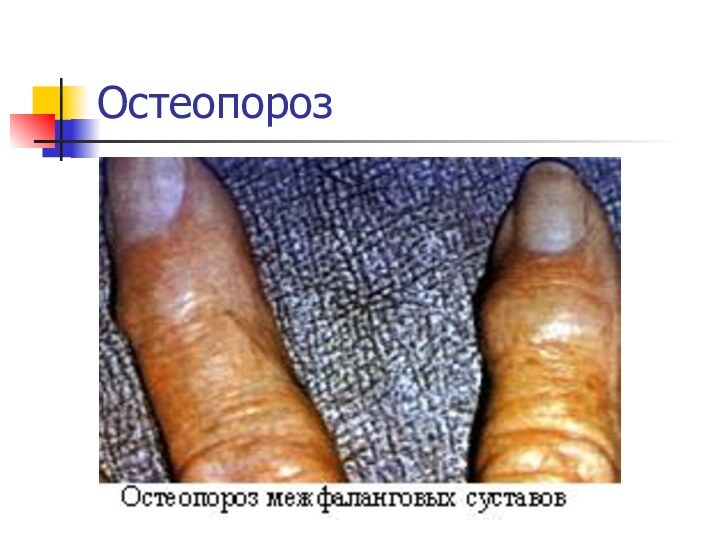
Ca2+ : снижение свертываемости крови, судороги, конвульсии, рахит у
детей (не окостенение хрящей), остеомаляция (размягчение костей), остеопороз (изрешечивание костей).
При избытке Ca2+: отложение солей (артриты, тромбозы, глаукома, известкование сосудов).
Кальций содержится в молоке, сыре, твороге и других молочных продуктах, свежих овощах.
Слайд 21
Дефицит кальция. Тонические судороги мышц кисти руки.
Слайд 25
Лекарственные препараты кальция:
1. CaCO3 – мел осажденный, антацидное
средство, применяется для уменьшения кислотности желудочного сока:
CaCO3+2HCl=CaCl2+CO2+H2O
2. CaCl2.6H2O -
кальций хлористый, применяют как противовоспалительное и антиаллергическое средство, для снятия сердечно-сосудистого спазма, для улучшения свертывания крови, при переломах костей и при ревматизме.
3. 2CaSO4.H2O - гипс, широко используется в травматологической и стоматологической практике, т.к. при замешивании его с водой образуется нерастворимый CaSO4.2H2O:
2CaSO4.H2O+3H2O=2(CaSO4.2H2O)
В результате происходит быстрое затвердение с некоторым увеличением объема, что используется для фиксации при переломах костей и получения хороших слепков в стоматологии.
Слайд 26
Магний
Электронная формула:
12Mg 1s22s22p63s2, с.о.=+2, координационное число 6,
магний образует комплексы с биолигандами, в составе которых есть
донорные атомы азота, поэтому магний – незаменимый компонент и активатор ферментов ( входит в состав хлорофилла, холинэстеразы и др.).
Слайд 27
Биороль магния:
1. Регулирует артериальное давление.
2. Уменьшает спазм сосудов.
3.
Регулирует работу сердца ( при недостатке магния – склонность
к инфарктам).
4. Участвует в обмене энергии, т.к. гидролиз АТФ происходит при обязательном участии магния:
[АТФ Мg]2– +H2O→ [АДФ Мg]– +H2PO4- + ∆H
5. Является строительным материалом костей и зубов: Mg3(PO4)2 и Mg(OH)2 . 4MgCO3 . H2O
6. Как комплексообразователь, входит в состав ферментов, катализирующих более 300 биохимических реакций (синтез нуклеиновых кислот, белков в рибосомах, гликолиз, гидролиз ацетилхолина в печени и др.).
7. Влияет на работу ЖКТ, является желчегонным, снижает уровень холестерина.
Слайд 28
Mg in vivo
(Mg)в организме=0,027%, макроэлемент, масса магния в
организме 20г.
Топография: дентин и эмаль зубов, костная ткань, поджелудочная
железа, скелетные мышцы, почки, печень, сердце.Mg2+ - внутриклеточный ион.
Слайд 29
Избыток и недостаток Mg:
В организм поступает с пищей:
рыба, морская капуста, соя, какао, грецкие орехи, фасоль, овсяные
хлопья, жёсткая вода.
Недостаток Mg2+ вызывает повышенную возбудимость ЦНС, судороги, плаксивое настроение, выпадение волос.
Избыток Mg2+ вызывает потерю чувствительности, сонливость, наркоз.
Слайд 30
Лекарственные препараты:
MgO - жженая магнезия, антацидное средство без
побочного действия:
MgO+2HCl=MgCl2+H2O.
MgO+MgO2 – «магний перекись», при желудочно-кишечных расстройствах,
обладает антацидным и бактерицидным действием:
MgO+MgO2+4HCl=2MgCl2+H2O+H2O2.
MgSO4 – сульфат магния:
а) слабительное средство;
б) гипотензивное средство, 10%-ный раствор (магнезия) внутривенно при гипертонических кризах.
2MgSiO3 . Mg(HSiO3)2 - тальк, в составе присыпок, мазей.
Mg(OH)2.4MgCO3.H2O – белая магнезия, антацидное, легкое слабительное.