Слайд 2
Общая характеристика группы.
28Cu 1s22s22p63s23p63d104s1;
[Ar] 3d104s1
47Ag
1s22s22p63s23p63d104s24p64d105s1; [Kr] 4d105s1
79Au 1s22s22p63s23p63d104s24p64d104f145s25p65d106s1;
[Xe] 4f145d106s2
Слайд 3
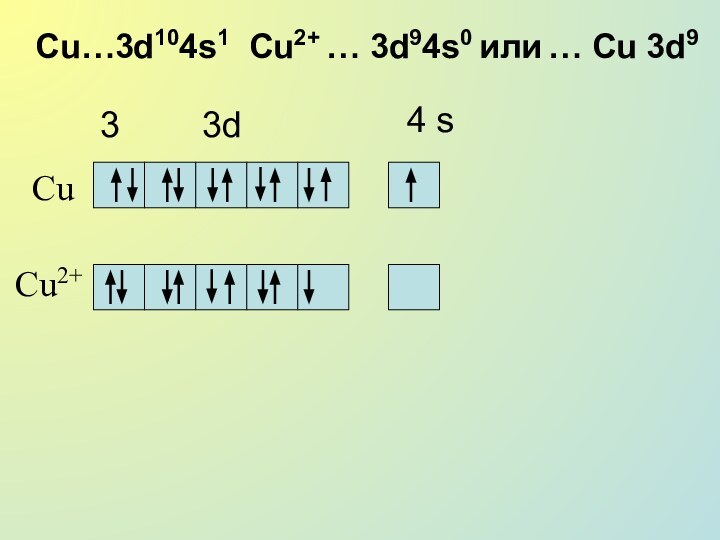
Cu…3d104s1 Cu2+ … 3d94s0 или … Cu
3d9
3
3d
4 s
Cu
Cu2+
Слайд 4
Стандартные электродные потенциалы
d-элементов 1Б группы
.. H2 …
Cu … Ag… Au …
Слайд 5
Для меди наиболее характерна степень окисления +2, для
серебра +1, для золота +3. Особая устойчивость степени окисления
+1 у серебра объясняется большей прочностью конфигурации 4d10, т. к. эта конфигурация образуется уже у Pd, предшествующего серебру в периодической системе.
Слайд 6
Радиусы атомов элементов побочной подгруппы I группы гораздо
меньше, чем у металлов главной подгруппы, поэтому медь, серебро
и золото отличаются большей плотностью, высокими температурами плавления.
Слайд 7
При переходе от меди к серебру радиус атомов
увеличивается, а у золота не изменяется, т. к. золото
расположено в периодической системе после лантаноидов и еще испытывает эффект лантаноидного сжатия. Плотность золота очень велика.
Химическая активность этих элементов невелика и убывает с возрастанием порядкового номера элемента.
Слайд 8
Нахождение в природе.
В природе встречается в виде различных
соединений,
Cu2S - медный блеск,
CuFeS2 - медный
колчедан (халькопирит), Cu3FeS3 - борнит,
Сu2 (ОН)2 СО3 или СuСО3 Сu(ОН)2 - малахит.
Слайд 9
Медь Сu
довольно мягкий металл красного цвета,
Tпл = 1083°С,
обладает высокой электро- и теплопроводностью,
образует
различные сплавы.
Слайд 10
Способы получения.
Продувание О2 через расплав сульфида
меди (I):
2Cu2S + 3О2 = 2Cu2O + 2SO2;
2Cu2O +
Cu2S = 6Cu + SO2.
Слайд 12
2Сu + О2 = 2СuО (800°С);
Сu + S
= CuS (350°C);
Сu + Сl2 =СuСl2;
2Сu + О2 +
H2О + СО2 = (СuОН)2СО3
(пленка зеленого цвета – образуется на
воздухе);
Слайд 13
Сu + 4НNО3(конц) = 2NO2 + Cu(NO3)2 +
2Н2О;
3Сu + 8НNО3(разб) = 2NO + 3Cu(NO3)2 + 4Н2О;
Сu
+ 2H2SO4(конц) = SO2 + CuSO4 + 2H2О;
2Сu + 2H2SO4(paзб) + О2 = 2CuSO4+ 2H2O (кипячение порошка Сu).
Слайд 14
Оксид меди (I) Сu2О - твердое вещество темно-красного
цвета, обладает основными свойствами.
Часть солей меди (I) растворима
в воде, но легко окисляется кислородом воздуха, устойчивы комплексные соединения меди (I)
[Cu(NH3)2]+:
Слайд 15
Сu2О + 2НСl(разб) = 2CuCl + H2O;
Сu2О +
4НСl(изб.) = 2H[CuCl2] + H2O;
2Сu2О + 8НСl(разб) + О2
= 4CuCl2 + 4Н2О;
2Сu2О + 4Н2О + О2 = 4Сu(ОН)2;
Сu2О + СО = 2Сu + СО2.
Гидроксид Cu(OH) не стоек и быстро окисляется.
Слайд 16
Оксид меди (II) СuО - твердое вещество красно-коричневого
цвета, проявляет основные свойства.
4CuO = 2Cu2O+ O2;
СuО +
Н2 = Сu + Н2О;
3СuО + 2А1 = 3Сu + Аl2О3;
СuО + С = Сu + СО;
Слайд 17
СuО + СО = Сu + СО2;
3СuО +
2NH3(г) = N2 + 3Сu + 3H2О;
СuО + 2НС1
= СuСl2 + Н2O
Слабые амфотерные свойства проявляются при сплавлении со щелочами:
СuО + 2NaOH = Na2СuO2 + Н2O
Слайд 18
Гидроксид меди (II) Сu(ОН)2 - соединение голубого цвета,
не растворим в воде, термически неустойчив, преобладают основные свойства,
слабый окислитель:
CuSO4 + 2NaOH(разб.) = Cu(OH)2↓ + Na2SO4;
Cu(OH)2 + 2HCl = CuCl2 + 2H2O;
Cu(OH)2 + 2NaOH(конц.) = Na2[Cu(OH)4];
Купраты щелочных металлов имеют синюю окраску
Слайд 19
2Cu(OH)2 + CO2 = Cu2 ( ОН)2 СО3-
+ H2O;
Cu(OH)2 = CuO + 2H2O;
Cu(OH)2 + 4NH4OH =
[Cu(NH3)4](OH)2 + 4H2O;
качественная реакция на альдегиды:
2Cu(OH)2 + СН3СНО = Cu2O + СН3СООН + 2H2O
Слайд 20
Соединения меди (II) – окислители:
CuSO4+ M = Cu
+ MSO4 (М =
Fе, Zn)
2CuSO4 + 2NaE + SO2 + 2H2O = 2CuE + 2H2 SO4 + 2Na2SO4
(E =Cl, Br , I, NCS)
Слайд 21
Соли меди (II) сильных кислот подвергаются в водных
растворах значительному гидролизу. Катион находится в гидратированном состоянии:
Cu2+ +
Н2О CuOH + + Н+;
Сu2++ 4Н2О [Cu(H2O)4]3+
[Cu(H2O)4]2+ + Н2О [Cu(OH)(H2O)3]+ + Н3О+
гидролиз в протолитической форме
Слайд 22
Комплексные соединения меди (II) с аммиаком, аминокислотами, многоатомными
спиртами.
[Cu(NH3)4](OH)2
Свойство Сu (ΙΙ) реагировать с белками и пептидами,
а также с биуретом (NH2 –CO–NH–CO–NH2) в щелочной среде с образованием окрашенных в сине-фиолетовый цвет комплексных соединений, используют для доказательства наличия пептидных связей. Реакция Сu (ΙΙ) с биуретом и белками называется биуретовой.
Слайд 23
Серебро.
Серебро Ag - тяжелый пластичный
металл с характерным блеском,
Тпл = 962°С,
обладает наибольшей
среди металлов электро- и теплопроводностью,
образует сплавы со многими металлами.
Слайд 25
Является малоактивным (благородным) металлом, непосредственно не взаимодействует с
О2, не реагирует с разбавленными растворами НСl, H2SO4
Слайд 26
2Ag + Cl2 = 2AgCl;
4Ag + 2SO2 +
2O2 = 2Ag2SO4; (>450°C)
2Ag + H2S = Ag2S + H2;
2Ag
+ 2HI = 2AgI + H2;
2Ag + 2H2SO4(конц.) = Ag2SO4 + 2H2O + SO2;
Ag + 2НNO3(конц.) = AgNO3 + H2O + NO2.
Слайд 27
Оксид серебра Ag2O - твердое вещество темно-коричневого цвета,
разлагается при нагревании, проявляет основные свойства,
плохо растворяется в
НСI и H2SO4 за счет образования на поверхности солей AgCl и Ag2SO4,
Слайд 28
2Ag2O = 4Ag + О2; (150°С)
Ag2O + 4NH4OH =
2[Ag(NH3)2]OH + ЗН2О;
Ag2O + 2НNО3(разб) = 2AgNO3 + Н2О;
Ag2O
+ H2О2(конц) = 2Ag + О2 + Н2О.
Слайд 29
Соли серебра.
Соли серебра не растворимы в воде, исключение
составляют AgF, AgNO3, AgClO3, AgClO4.
Взаимодействие с гидратом аммиака, тиосульфатом
натрия, карбонатом аммония (повторить качественные реакции на галогениды – НЛВ).
Слайд 30
качественная реакция на хлорид-ион:
HCl + AgNO3 → AgCl↓
+ HNO3
NaCl + AgNO3 → AgCl↓ + NaNO3
AgCl +
2NH3 • H2O → [Ag(NH3)2]Cl + 2H2O
AgCl + (NH4)2СO3 → [Ag(NH3)2]Cl + СO2↑
+ H2O
AgCl + 2Na2S2O3 → Na3[Ag(S2O3)2] + NaCl
Слайд 31
качественная реакция на бромид-ион:
NaBr + AgNO3 → AgBr↓
+ NaNO3
AgBr + 2NH3 • H2O → [Ag(NH3)2]Br +
2H2O
AgBr + (NH4)2СO3 ≠
AgBr + 2Na2S2O3 → Na3[Ag(S2O3)2] + NaBr
Слайд 32
качественная реакция на иодид-ион:
NaI + AgNO3 → AgI↓
+ NaNO3
AgI + 2NH3 • H2O ≠
AgI +
(NH4)2СO3 ≠
AgI + 2Na2S2O3 → Na3[Ag(S2O3)2] + NaI
Слайд 33
Химические основы применения соединений серебра в качестве лечебных
препаратов в фармацевтическом анализе
Растворимые соли серебра, попадая в организм
в больших дозах, вызывают острое отравление, подобно другим тяжелым элементам-металлам.
При этом, как правило, серебро связывается атомами серы белков. В результате инактивируются соответствующие ферменты, свертываются белки.
Слайд 34
Вода, содержащая ионы серебра порядка 10-8 ммоль/л, обладает
бактерицидным действием, что обусловлено образованием нерастворимых альбуминатов.
Эффективность бактерицидного
действия серебра выше, чем у хлора, хлорной извести, карболовой кислоты.
Слайд 35
Золото Au –
желтый, ковкий, тяжелый металл,
Тпл =
1064°С,
благородный металл.
Нахождение в природе. Встречается в виде самородного
золота
Слайд 37
Не реагирует с водой, кислотами, щелочами, кислородом, азотом,
углеродом, серой.
Переводится в раствор "царской водкой",
со ртутью
образует амальгаму,
при нагревании взаимодействует с галогенами.
Слайд 38
Au + НNО3(конц) + 4НСl(конц) = H[AuCl4] +
NO + 2H2О;
2Au + 3Сl2 = 2AuCl3 (130°С)
Слайд 39
Оксид и гидроксид золота (III) нерастворимы в воде,
проявляют амфотерные свойства:
Au(OH)3 + 3HCl = AuCl3
+ 3H2O
Au(OH)3 + 4HNO3 = H[Au(NO3)4] + 3H2O
Au(OH)3 + NaOH = Na[Au(OH)4] - гидроксоаурат (III)
Слайд 40
Соединения Au (III) проявляют окислительные свойства:
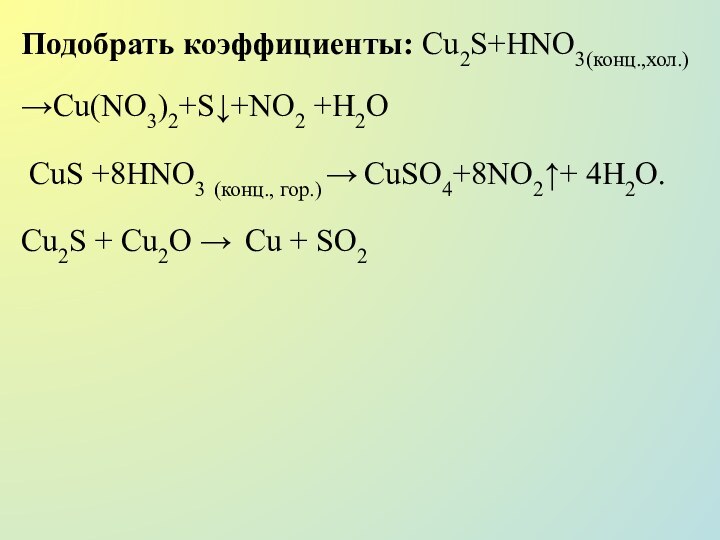
Подобрать коэффициенты:
AuCl3 +
H2O2 (конц.) → Au (коллоид) +O2 + HCl
H[AuCl4] +SO2+H2O
→H[AuCl2]+H2SO4 + HCl










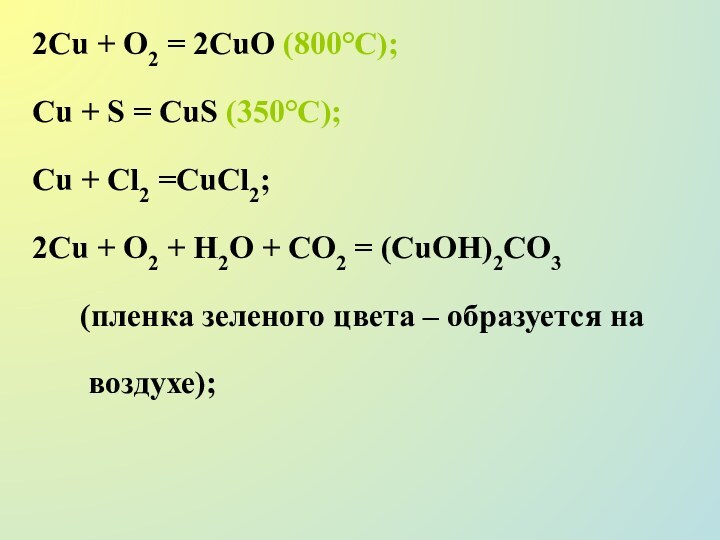
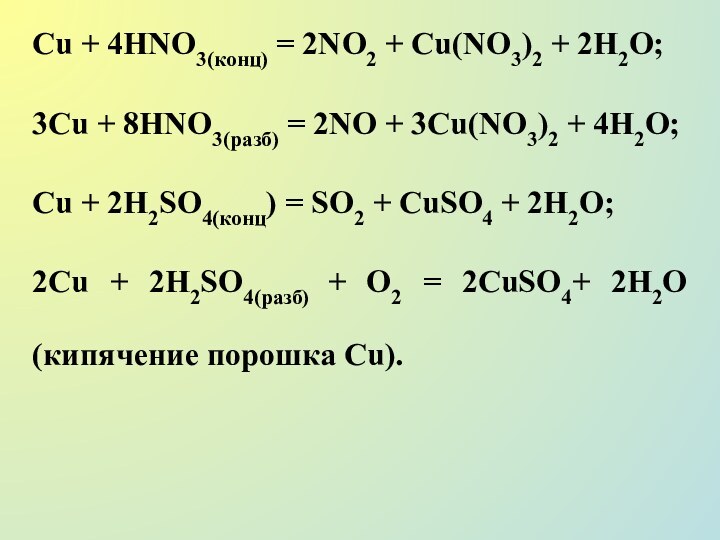

![d-Элементы I Б группы. Сu2О + 2НСl(разб) = 2CuCl + H2O;Сu2О + 4НСl(изб.) = 2H[CuCl2] +](/img/tmb/13/1230467/aaef7d3a404eadeeb85c1041062e0eae-720x.jpg)

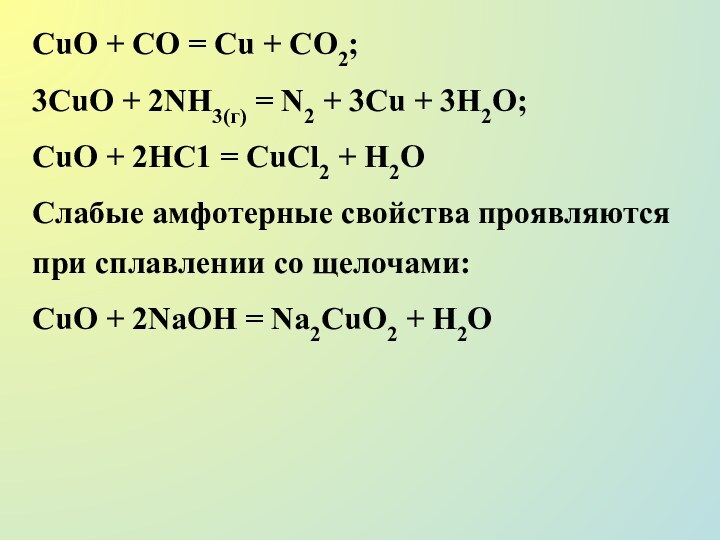




2Свойство Сu (ΙΙ)](/img/tmb/13/1230467/2a97d973e0ce5c8986f2080d6f855dd2-720x.jpg)



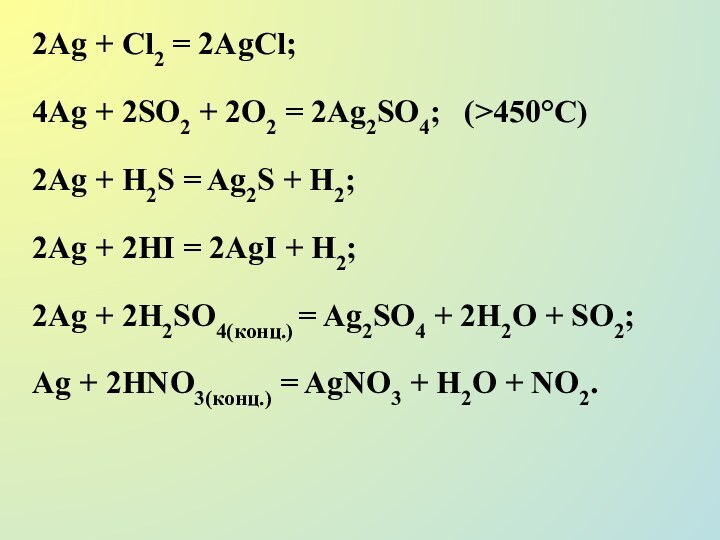

![d-Элементы I Б группы. 2Ag2O = 4Ag + О2; (150°С)Ag2O + 4NH4OH = 2[Ag(NH3)2]OH + ЗН2О;Ag2O +](/img/tmb/13/1230467/1c56c080d23bc7a041db3e193c735854-720x.jpg)









![d-Элементы I Б группы. Au + НNО3(конц) + 4НСl(конц) = H[AuCl4] + NO + 2H2О;2Au + 3Сl2 = 2AuCl3 (130°С)](/img/tmb/13/1230467/1b7512570984f809332ae2fa9abdefc3-720x.jpg)