Слайд 2
ЭЛЕКТРОЛИЗ
Электролизом называется совокупность процес-сов, протекающих при прохождении постоянного
электрического тока через систему, состоящую из двух электродов и
расплава или раствора электролита.
Как и в гальваническом элементе, электрод, на котором при электролизе происходит восстановле-ние, называется катодом, а электрод, на котором осуществляется процесс окисления, — анодом.
Слайд 3
1. на катоде в первую очередь восстанавливаются наиболее
сильные окислители (идет реакция с наиболее положительным потенциалом);
2. на
аноде в первую очередь окисляются наиболее сильные восстановители (идет реакция с наиболее отрицательным потенциалом);
3. совместный разряд ионов или ионизация ионов, молекул возможна при относительно малом отличии потенциалов.
ЭЛЕКТРОЛИЗ.
При определении продуктов электролиза водных растворов электролитов следует учитывать, что:
Слайд 4
ЭЛЕКТРОЛИЗ.
1. Так, при электролизе кислого водного раствора соли
никеля при стандартных концентрациях (или, точнее, активностях) ионов Н+
и Ni2+ ([Н+] = [Ni2+] = 1 моль/л) на катоде возможно восстановление как иона никеля:
Ni2+ + 2e- = Ni, φ1 = -0,25 В ,
так и иона водорода:
2Н+ + 2е- = Н2, φ2 = 0.
Но поскольку φ1 < φ2, то в этих условиях на катоде будет выделяться именно водород.
В тоже время в нейтральном р-ре (рН=7) на катоде будет выделяться никель. Почему ?
Слайд 5
В нейтральном растворе ([Н+] = 10-7 моль/л) потенциал
водородного электрода φ1 = —0,41 В. В этом случае
при прежней концентрации иона никеля (1 моль/л) φ1 > φ2, поэтому на катоде будет выделяться никель.
ЭЛЕКТРОЛИЗ.
Ответ на вопрос:
Слайд 6
ЭЛЕКТРОЛИЗ
(процессы на аноде)
2. При электролизе водного раствора сульфата
меди с инертными электродами (например, угольными) на аноде может
окисляться как сульфат-ион
2SО42- " = S2О82- + 2е‾, φо1 = 2,01 В,
так и вода*:
2Н2О = О2 + 4Н+ + 4е-, φо2 = 1,23 В.
Поскольку (φо2 << φо1 , то в данном случае будет осуществляться второй из возможных процессов, и на аноде будет выделяться кислород.
Слайд 7
Во многих случаях электролиза применяют раство-римые аноды из
металла, восстанавливаемого на катоде. Нерастворимыми являются аноды из золота,
платиновых металлов, графита, диоксида свинца, титана, оксида рутения и других веществ.
ЭЛЕКТРОЛИЗ.
Однако при замене инертного электрода медным становится возможным протекание еще одного окислительного процесса — анодного растворения меди:
Сu = Сu2+ + 2е- , φо1 = 0,34 В.
Поскольку, φо3 << φо1 и φо3 << φо2 , то при указан-ных условиях на аноде будет происходить именно окисление меди. **
**
Слайд 8
При электролизе водных растворов нитратов (NO3‾), перхлоратов (ClO4‾)
и фосфатов (PO43-), как и в случае сульфатов (SO42-),
на инертном аноде обычно происходит окисление воды с образованием свободного кислорода.
ЭЛЕКТРОЛИЗ.
Пример 1. Написать уравнения процессов, происходящих при электролизе водного раствора сульфата натрия с инертным анодом
Слайд 9
ЭЛЕКТРОЛИЗ.
Р е ш е н и е .
На катоде возможны процессы:
φо1 = -2,71 В
2Н2О + 2е-
= Н2 + 2ОН‾ , φо2 = -0,41 В
Поскольку, φо1 << φо2 , на катоде будет происходить электрохимическое восстановление воды, сопровож-дающееся выделением водорода.
На аноде возможны процессы:
2Н2О = О2 + 4Н+ + 4е- ,
2SО42- = S2O82- + 2e- ,
Na+ + e- = Na,
φо4 = 2,1 В
φо3 = 1,23 В
Таким образом на аноде будет происходить окисление воды, приводящее к выделению кислорода.
Слайд 10
Умножая уравнение катодного процесса на два и складывая
его с уравнением анодного процесса, получаем суммарное уравнение процесса
электро-лиза:
ЭЛЕКТРОЛИЗ.
6Н2О = 2Н2 ↑ + 4ОН‾ + О2↑ + 4Н+ .
(у катода) (у анода)
Приняв во внимание, что одновременно происходит накопление ионов Na+ в катодном пространстве и ионов SО42- в анодном пространстве, суммарное уравнение процесса можно записать в следующей форме:
6H2О + 2Na2SО4 = 2H2↑+ 4Na+ + 4ОН- + О2 ↑+ 4H+ + 2SO42-
Слайд 11
ЗАКОНЫ ФАРАДЕЯ
Количественная характеристика процессов электро-лиза определяется законами, установленными
Фарадеем. Им обычно придают следующую общую формулировку ( з
а к о н Фа р а д е я):
масса электролита, подвергшаяся превраще-нию при электролизе, а также массы веществ, выделившиеся на электродах прямо пропорци-ональны количеству электричества, прошед-шего через раствор или расплав электролита, и эквивалентным массам соответствующих веществ.
Слайд 12
Закон Фарадея выражается следующим уравнением:
т = ЭIt /
F.
Здесь т — масса образовавшегося или подвергшегося превращению вещества;
Э — его эквивалентная масса; I — сила тока; t — время; F — постоянная Фарадея (96500 Кл/моль), т. е. количество электричества, необходимое для осуществления электрохимического превращения одного эквива-лента вещества.
ОБЪЕДИНЕННОЕ УРАВНЕНИЕ
ЗАКОНОВ ФАРАДЕЯ:
Слайд 14
Пример 1. Ток силой 2,5 А, проходя через
раствор электролита, за 30 мин выделяет из раствора 2,77
г металла. Найти эквивалент-ную массу металла.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Слайд 15
Решение 1. Решим уравнение закона Фарадея относительно эквивалентной
массы металла и подставим в него данные задачи
(т =
2,77 г, I = 2,5 A, t = 30 мин = 1800 с):
Э = mF/(It) = 2,77•96500/(2,5 • 1800) = 59,4 г/моль.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Слайд 16
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 2. Какова масса меди, выделившейся
на электроде при прохождении через электрохими-ческую систему количества электричества,
равного 2F и выходе меди по току, равном единице (100%)?
Слайд 17
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Решение 2. Согласно законов Фарадея при
прохождении количества электричества, равного 2F, выделится 2 моль эквивалента
меди, что составляет:
тСи = ЭСu· 2 = (63,57/2) г/моль ·2 моль = 63,57 г,
Слайд 18
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 3. Определите выход по
току водорода, выделенного на электроде при нормальных условиях, если
объем его составил 112 л при прохождении через электрод 1000 А·ч.
Слайд 19
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Решение 3. Эквивалентный объем моль водорода
при н. у. составляет 22,4/2 = 11,2 л. Для
выделения такого объема водорода требуется количество электричества, равное 1F, или 26,8 А·ч. Следовательно, для выделения 112 л требуется 268 А ·ч. Найдем выход по току водорода:
Bj =
= 0,27 (или 27%).
QH2
Q
268 А∙ч
1000 А∙ч
=
Слайд 20
Пример 4. Ток силой 6 А пропускали через
водный раствор серной кислоты в течение 1,5 ч. Вычислить
массу разложившейся воды и объем выделившихся кислорода и водорода (условия нормальные)
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Слайд 21
Решение 4. Массу разложившейся воды находим из уравнения
закона Фарадея, имея в виду, что
1,5 ч =
5400 с и Эн2о — 9 г/моль:
mн2о = ЭIt /F = 9 • 6 • 5400/96500 = 3,02 г.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
V = VЭIt /F.
Здесь V — объем выделившегося газа, л; VЭ — его эквивалентный объем, л/моль. Поскольку при н.у. VЭ,Н2 = 11,2 л/моль, а VЭ,О2 = 5,6 л/моль, то полу-чаем:
11,2∙6∙5400
96 500
VН2 =
= 3,76л ;
5,6∙6∙5400
96 500
VО2 =
= 1,88л ;
При вычислении объемов выделившихся газов представим уравнение закона Фарадея в следую-щей форме:
Слайд 22
687. Составить схемы электролиза водных растворов H2SO4, СuСl2,
Рb(NО3)2 с платиновыми электродами.
689. Написать уравнения электродных процессов, протекающих
при электролизе водных растворов FeCl3 и Са(NОз)2 с инертным анодом.
695. Имеется раствор, содержащий КСl и Cu(NO3)2 . Предложить наиболее простой способ получения практически чистого KNO3.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
Слайд 23
699. Вычислить массу серебра, выделившегося на катоде при
пропускании тока силой 6 А через раствор нитрата серебра
в течение 30 мин.
700. Сколько времени потребуется для полного разложения 2 молей воды током силой 2 А?
702. Найти объем кислорода (условия нормаль-ные), который выделится при пропускании тока силой 6 А в течение 30 мин через водный раствор КОН.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
Слайд 24
707. За 10 мин из раствора платиновой соли
ток силой 5 А выделил 1,517 г Pt. Определить
эквивалентную массу платины.
709. При прохождении через раствор соли трех-валентного металла тока силой 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислить атомную массу металла.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
Слайд 26
710. Какой процесс протекает при электролизе водного раствора
хлорида олова (II) на оловянном аноде:
a) Sn →
Sn +2e- ; б) 2Сl‾ → Сl2 + 2 е- ;
в) 2Н2О → О2 + 4Н+ + 4е- ?
711. При электролизе водного раствора сульфата никеля (II) на аноде протекает процесс:
2Н2О = 2О2+ 4Н+ + 4е-.
Из какого материала сделан анод:
а) из никеля; б) из меди; в) из золота?
Слайд 27
712. При электролизе водного раствора сульфата калия значение
рН раствора в приэлектродном пространстве возросло. К какому полюсу
источника тока присоединен электрод:
а) к положительному; б) к отрицательному?
713. При электролизе водного раствора соли значение рН в приэлектродном пространстве одного из электродов возросло. Раствор какой соли подвергся электролизу:
а) КСl; б) СuСl2; в) Cu(NO3)2 ?
Слайд 28
714. При электролизе водного раствора NaOH на аноде
выделилось 2,8 л кислорода (условия нормальные). Сколько водорода выделилось
на катоде:
а) 2,8 л; б) 5,6 л; в) 11,2 л; г) 22,4 л?
715. При электролизе раствора хлорида меди (II) масса катода увеличилась на 3,2 г. Что произошло при этом на медном аноде:
а) выделилось 0,112 л Сl2; б) выделилось 0,56 л O2 ; в) перешло в раствор 0,1 моля Сu2+; г) перешло в раствор 0,05 моля Сu2+?
Слайд 30
КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
Коррозия — это разрушение металла
в результате его физико-химического взаимодействия с окружающей средой. По
механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию.
Химическая коррозия представляет собой самопроизвольное разрушение металлов в среде окислительного газа (например, кислорода, галогенов) при повышенных температурах или в жидких неэлектролитах.
nМ + m/2O2 = MnOm
Слайд 31
ХИМИЧЕСКАЯ КОРРОЗИЯ
Рассмотрим химическую коррозию в газах (газовую коррозию),
в частности, коррозию в атмосфере кислорода. Уравнение реакции окисления
металлов кислородом можно записать в общем виде:
nМ + m/2O2 = MnOm
В соответствии с законами химической термодина-мики эта реакция, как и другие реакции коррозии, может протекать лишь при условии уменьшения энергии Гиббса системы, т. е. при условии, если энергия Гиббса меньше нуля:
∆G < 0.
Слайд 32
Так как, по определению, энергия Гиббса образо-вания простых
веществ равна нулю, то энергия Гиббса окисления металлов равна
энергии Гиббса образования оксидов. Энергию Гиббса реакции окисления рассчитывают по уравнению:
КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
mRT
2
ln ṕo2
∆G = ∆G0 −
где ∆G0 - стандартная энергия Гиббса реакции;
ṕo2 - относительное парциальное давление
кислорода.
Слайд 33
Для подавляющего большинства металлов стандартная энергия Гиббса их
окисления ниже нуля, что говорит о возможности протекания этой
реакции при атмосферном давлении кислорода.
Однако энергия Гиббса реакции меняется при изменении температуры, соответственно меняется и давление кислорода, при котором ∆G0 > 0.
Отметим: термодинамика указывает лишь на возможность протекания процессов, но не может предсказать их скорость.
КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
Слайд 34
Электрохимическая коррозия протекает при контакте металла с растворами
электролитов.
Например, наиболее распространенная атмосфер-ная коррозия протекает в тонких
пленках электро-литов, которые возникают на поверхности металла в результате адсорбции, конденсации или прямого попадания воды и растворения в ней коррозионно-активных газов и солей (O2, SO2, СО2, NO2, NaCl и др.).
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Слайд 35
Таким образом, при электрохимической коррозии разрушение металла происходит
в результате работы огромного количества коррозионных микро-элементов. При этом
на корродирующем металле протекает анодная реакция:
Анод: М → Мn+ + nе,
а на участках металла с более положительным потенциалом - катодное восстановление окислителя (Ох):
Катод: Ох + nе → Red
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Слайд 36
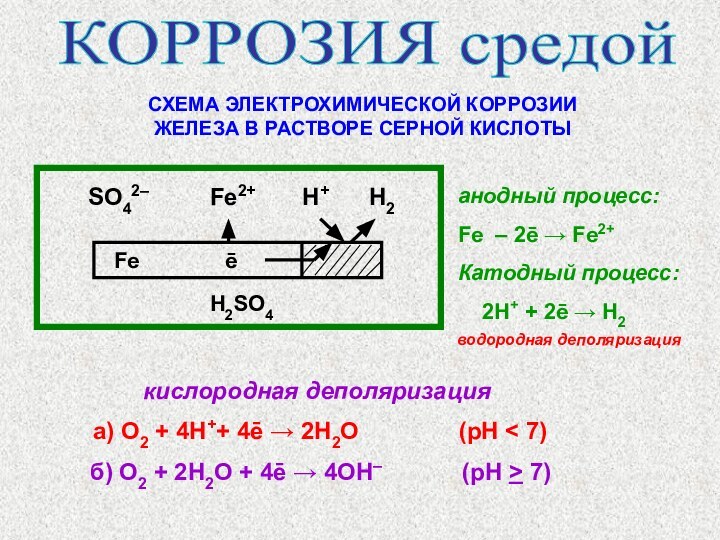
КОРРОЗИЯ средой
СХЕМА ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
ЖЕЛЕЗА В РАСТВОРЕ СЕРНОЙ КИСЛОТЫ
SO42–
Fe2+ H+ H2
Fe
ē
H2SO4
кислородная деполяризация
а) O2 + 4H++ 4ē → 2Н2O (pH < 7)
б) O2 + 2Н2O + 4ē → 4ОH– (pH > 7)
анодный процесс:
Fe – 2ē → Fe2+
Катодный процесс:
2Н+ + 2ē → Н2
водородная деполяризация
Слайд 37
Наиболее распространенными окислителями при электрохимической коррозии являются молекулы
O2 воздуха и ионы водорода Н+ электролита.
Коррозия с участием
кислорода называется коррозией с кислородной деполяризацией.
В зависимости от рН среды возможны два механизма ионизации (восстановления) кислорода:
а) в щелочной или нейтральной среде:
O2 + 2Н2O + 4е → 4OН– (рН>7)
б) в кислой среде:
O2 + 4Н+ + 4е → 2Н2O (рН < 7)
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Слайд 38
Аналогично, при коррозии с выделением водоро-да
(с водородной деполяризацией) реакции выделения водорода имеют вид:
а) в нейтральной или щелочной среде:
2Н2O + 2е → Н2 + 2ОН− (рН>7)
б) в кислой среде:
2Н+ + 2е → Н2 (рН<7)
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Если в качестве окислителя одновременно высту-пают O2 и Н+, то такая коррозия называется корро-зией со смешанной деполяризацией.
Слайд 39
Так как энергия Гиббса реакции непосредственно связана с
ЭДС элемента
Еэ = - ∆G/nF,
то возможность протекания
коррозии может быть определена по знаку ЭДС элемента, которая равна разности потенциалов катода и анода ЕЭ = φК — φА.
Отсюда следует, что коррозия возможна при условии, что потенциал окислителя (или катода) положительнее потенциала металла:
φOK > φMn+/M или φK > φMn+/M
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Слайд 40
Равновесный потенциал кислородного электрода при 298
К описывается уравнением:
φо2/он- = 1,227 + 0,0147lg ṕo2 -
0,059рН,
а потенциал водородного электрода - уравнением:
φн+/н2 = - 0,059рН - 0,0295lg ṕн2.
В водных средах, содержащих Н+ и O2, металлы корродируют по-разному, в зависимости от рН:
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Слайд 41
а) если φ металла положительнее φ кислородного электрода,
то коррозия металла невозможна. Например, потенциал золота во всей
области рН положительнее потенциала кислородного электрода, поэтому золото с поглощением O2 и выделением Н2 корродировать не может, так как φOK < φAu+/Au ;
б) если φ металла положительнее φ водородного электрода и отрицательнее потенциала кислородного электрода, коррозия возможна с поглощением кислорода, например,
ЕCu2+/Cu < Ео2/н2о
и невозможна с выделением водорода:
ЕCu2+/Cu > Ен+/н2.
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Слайд 42
в) если потенциал металла отрицательнее потенциала водородного электрода, то
возможна коррозия как с поглощением кислорода, так и с
выделением водорода.
К таким металлам относятся щелочные и щелочноземельные металлы, магний, алюминий, цинк и др.
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Слайд 43
ПРИМЕРЫ РЕШЕНИЯ
ЗАДАЧ
По темме «Коррозия металлов»
Слайд 44
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
IX. 1. Во сколько раз возрастает
толщина пленки при увеличении продолжительности равномерной газовой коррозии титана
от 8 до 100 ч при 300°С.
Решение. На алюминии, хроме (при t < 350°C) и некоторых других металлах пленка оксида растет во времени τ по логарифмическому закону [1, § 10.2]
δ = k ln τ,
где δ - толщина пленки. Соответственно:
δ = k3 ln8,
δ = k3 ln100.
Отсюда следует, что толщина пленки (δ100/δ8) увеличивается в 2,53 раза (ln(100/8) = 2,53).
Слайд 45
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
IX.2. Определите скорость равномерной коррозии железа
в [г/(м2·год)] и в (мм/год), если плотность коррозионного тока
составляет 0,02 А/м2.
Слайд 46
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Решение. Скорость равномерной коррозии, выраженная в
г/(м2·с), равна:
v = (MЭi)/F,
Умножая эту величину на число секунд
в сутки (3600·24) и число дней в году (365), получим скорость коррозии в году v = 170 г/(м2·год).
Для перевода этой размерности в мм/год используем плотность железа ρ = 7,87 г/см3. После преобразо-вания единиц получим v = 0,022 мм/год.
где МЭ - молярная масса эквивалента металла; i - плотность тока коррозии.
Слайд 47
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
IX.3. Определите термодинамическую возмож-ность газовой коррозии
изделия из углеродистой стали, протекающей по реакции:
Fe(т) + Н2O(г)
= FeO(т) + Н2(г)
если это изделие эксплуатируется при 700°С под действием водяного пара с относительным давлением ṕH2O = 6 и ṕH2= 1.
Слайд 48
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Решение. Условием протекания является ∆G
0. Энергия Гиббса для указанного процесса зависит от парциального
давления окислительного компо-нента ṕн2о следующим образом (при ṕH2 = 1):
∆G0T,корр = ∆G0T,корр - RTln ṕн2о.
Стандартное значение энергии Гиббса ∆G0T,КОРР при температуре Т можно рассчитать по формуле:
∆G0T,корр = ∆H0T,корр - T∆S0T,корр.
Слайд 49
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Допустим, что ∆H0T,корр, не
зависит от темпера-туры, тогда:
∆G0973,корр = ∆H0298,корр -973∆S0298,корр,
где ∆H0298,корр и ∆S0298,корр определены по закону Гесса для заданной реакции:
∆H0298,корр = (∆fH0298,FeO + ∆fH0298,н2 ) − (∆fH0298,Fe + ∆fH0298,н2o) =
= (-263,68 + 0)-(0-241,84) = -21,84 кДж,
Слайд 50
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
∆S0298,корр = (S0FeO(т) + S0н2(г) )
- (S0Fe(т) + S0н2о(г)) = (58,79+130,6) - (27,15+ 188,84)
= -26,61 Дж/К,
∆G0T,корр = −21840 − 973(−26,61) = + 4051,5 Дж,
∆G973,корр = 4051,5 − 8,314 • 973n6 = − 10404,36 Дж.
Таким образом, ∆G0973,корр < 0, и газовая коррозия изделия из низкоуглеродистой стали при 700°С, относительных давлениях ṕн2о = 6 и ṕн2 = 1 возможна.
Слайд 51
IX.5. Возможна ли электрохимическая коррозия олова (Sn) в
водном растворе при рН 6 при контакте с воздухом.
Напишите уравнения реакций анодного и катодного процессов. При каких значениях рН возможна коррозия с выделением водорода?
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Слайд 52
Решение. Используя П. 14, найдем стандартный электродный потенциал
олова (E0sn2+/sn = -0,136 В). По уравнению Нернста определим
равновесные потенциалы вероятных окислителей (Н+ и О2) при 25°С, ṕн2о = 1, ṕо2 = 0,21
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
E0н+/н2 = - 0,059·рН = - 0,059·6 = - 0,354 В,
E0о2/он- = 1,227 − 0,059рН + 0,01471g0,21 =
1,227 − 0,059 ·6 − 0,01 = 0,873 В.
Рассчитаем ЭДС предполагаемых коррозионных микроэле-ментов:
ЕI = ЕK(н2) - ЕА = -0,354 В − (-0,136 В) = -0,218 В < 0
коррозия с выделением водорода невозможна.
ЕII = ЕК(о2) - ЕА = 0,873 В − (-0,136 В) =1,009 В > 0
коррозия с поглощением кислорода возможна
Слайд 53
Таким образом, уравнения реакций анодного и катодного процессов
выглядят следующим образом:
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Анод Sn → Sn2+ +
2e
Катод 1/2О2 + 2Н+ + 2е → Н2О
Для выяснения диапазона значений рН, при которых возможна коррозия с водородной деполяризацией, решим неравенство:
ЕI = ЕK(н2) - ЕА > 0.
После подстановки значений электродных потенциа-лов получим:
- 0,059рН - (- 0,136) > 0.
Откуда следует, что при значениях рН< 0,136/0,059 = 2,26 идет процесс с выделением водорода.
Слайд 54
IX.6. Определите, будет ли корродировать медь (Сu) в
деаэрированном (без содержания кислорода) растворе CuSO4 в кислом растворе
с рН 0 и выделением водорода при его относительном давлении рн2 = 0,1.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Слайд 55
Решение. Стандартный потенциал меди (см. П. 14) составляет
Е0сu2+/сu = + 0,337 В, а потенциал водорода рассчитываем
по уравнению Нернста:
Epн+/н2 = - 0,02951g ṕн2 - 0,059рН.
После подстановки рН 0 и рн2 = 0,1, получим:
E0н+/н2 = + 0,0295 В.
ЭДС коррозионного микроэлемента:
Е = ЕK(н2) - ЕА = + 0,0295 - 0,337 < 0
— коррозия протекать не будет.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Слайд 56
9.4 Определите термодинамическую возможность газовой коррозии изделия из
углеродистой стали (Fe) до Fе2О3 под действием кислорода, находящегося
под относительным давлением ṕо2= 0,2 и температуре 350°С.
9.5 Определите термодинамическую возможность газовой коррозии изделия из никеля (Ni) до NiO под действием кислорода с относительным давлением ро2 = 1,4 и температуре 800°С. Определите парциальное давление кислорода, при котором прекращается газовая коррозия при указанной температуре.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ




![ЭЛЕКТРОЛИЗ. КОРРОЗИЯ В нейтральном растворе ([Н+] = 10-7 моль/л) потенциал водородного электрода φ1 =](/img/tmb/14/1330828/5362062bf7fd723024be201494ae79d8-720x.jpg)






































![ЭЛЕКТРОЛИЗ. КОРРОЗИЯ ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧIX.2. Определите скорость равномерной коррозии железа в [г/(м2·год)] и в](/img/tmb/14/1330828/73eee3008044a03d652a766d54a6797e-720x.jpg)