резкий запах.
Хорошо растворимы в воде.
Например, в 1
объеме воды при 0°С растворяется до 507 объемов хлороводорода и 612 объемов бромоводорода.Дымят на воздухе.
Токсичны.
12.12.2017
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть




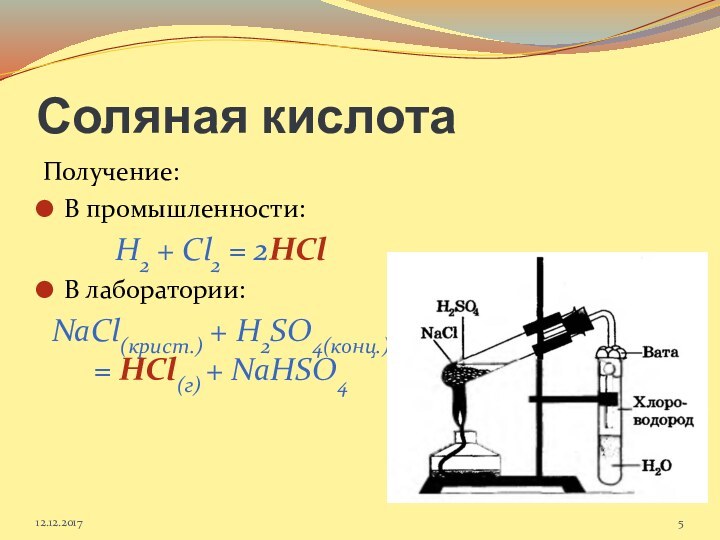









12.12.2017
что объясняется
уменьшением в этом же направлении энергии связи;
увеличением межъядерного расстояния.
12.12.2017
Самопроверка:
12.12.2017
12.12.2017
Na+
F-
Ca2+, Cl-
CaF2↓
Na+, Cl-
Выпадает белый осадок
12.12.2017
12.12.2017