- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Гидролиз солей
Содержание
- 2. Гидролиз солей.Гидролиз – это реакция обменного разложения веществ водой.
- 3. Гидролиз органических веществ.1. Гидролиз галогеналканов. С2Н5Сl +
- 4. Гидролиз неорганических веществ.Гидролизу подвергаются растворы солей. Следовательно,
- 5. Классификация солей.Любую соль можно представить как продукт
- 6. Классификация солей.3. Соли, образованные слабой кислотой и
- 7. Соли, образованные сильным основанием и слабой кислотой.
- 8. Соли, образованные сильным основанием и слабой кислотой.Гидролиз
- 9. Соли, образованные сильной кислотой и слабым основанием.NH4Cl
- 10. Соли, образованные сильной кислотой и слабым основанием.Гидролиз по катиону:Обратимый процесс.Химическое равновесие смещено влево.Среда кислотная, рН
- 11. Соли, образованные слабой кислотой и слабым основанием.
- 12. Соли, образованные слабой кислотой и слабым основанием.Гидролиз
- 13. Соли, образованные сильной кислотой и сильным
- 14. Гидролиз солей.Гидролиз можно усилить:Добавить воды.Нагреть раствор (увеличится
- 15. Скачать презентацию
- 16. Похожие презентации
Гидролиз солей.Гидролиз – это реакция обменного разложения веществ водой.














Слайд 3
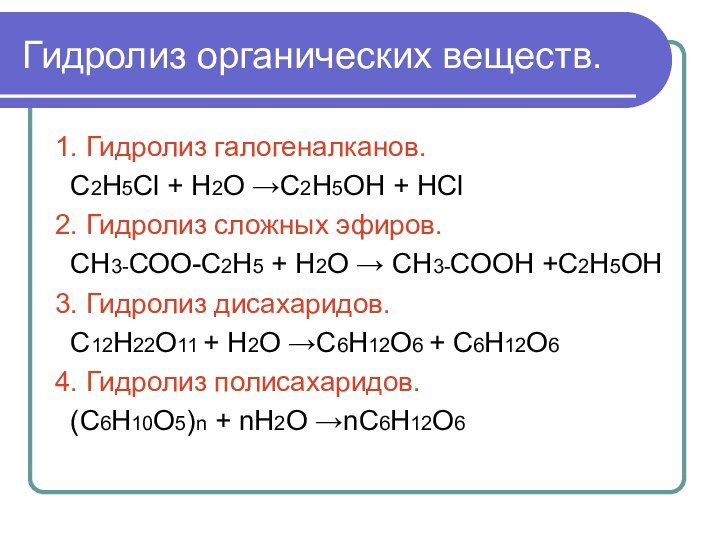
Гидролиз органических веществ.
1. Гидролиз галогеналканов.
С2Н5Сl + Н2О
→С2Н5ОН + НСl
2. Гидролиз сложных эфиров.
СН3-СОО-С2Н5 + Н2О
→ СН3-СООН +С2Н5ОН3. Гидролиз дисахаридов.
С12Н22О11 + Н2О →С6Н12О6 + С6Н12О6
4. Гидролиз полисахаридов.
(С6Н10О5)n + nН2О →nС6Н12О6
Слайд 4
Гидролиз неорганических веществ.
Гидролизу подвергаются растворы солей. Следовательно, водные
растворы солей имеют разные значения рН и различные типы
сред:Кислотную (рН<7).
Щелочную (рН>7).
Нейтральную (рН=7).
Слайд 5
Классификация солей.
Любую соль можно представить как продукт взаимодействия
основания с кислотой.
В зависимости от силы основания и кислоты
можно выделить 4 типа солей:1. Соли, образованные сильным основанием и слабой кислотой (КСN, NaCH3COO).
2. Соли, образованные сильной кислотой и слабым основанием (СuCl2, FeSO4, Mn(NO3)2.
Слайд 6
Классификация солей.
3. Соли, образованные слабой кислотой и
слабым основанием
(NH4CN, Cu(CH3COO)2).4. Соли, образованные сильной кислотой и сильным основанием
(NaCl, K2SO4, BaI2).
Слайд 7
Соли, образованные сильным основанием и слабой кислотой.
NaCN
+ Н2О ↔ NaOH + HCN
NaCN ↔Na+ + CN‾Н2О ↔ OH ‾ + H+
Полное ионное уравнение гидролиза:
Na+ + CN¯ + Н2О ↔ Na+ + OH¯ + HCN
Сокращённое уравнение гидролиза:
CN¯ + Н2О ↔ OH¯ + HCN
рн >7, среда щелочная, гидролиз по аниону.
Слайд 8
Соли, образованные сильным основанием и слабой кислотой.
Гидролиз по
аниону:
Обратимый процесс.
Химическое равновесие смещено влево.
Реакция среды - щелочная, рН>7.
При
гидролизе солей, образованных слабыми многоосновными кислотами образуются кислые соли.
Слайд 9
Соли, образованные сильной кислотой и слабым основанием.
NH4Cl +
H2O ↔ NH3·H2О + НСl
NH4Cl ↔ NH4+ + Cl¯Н2О ↔ OH¯ + H+
Полное ионное уравнение гидролиза:
NH4+ + Cl¯ + Н2О ↔ NH3 · H2О + H+ + Cl¯
Сокращённое уравнение гидролиза:
NH4+ + Н2О ↔ NH3 · H2О + H+
рн <7, среда кислотная, гидролиз по
катиону.
Слайд 10
Соли, образованные сильной кислотой и слабым основанием.
Гидролиз по
катиону:
Обратимый процесс.
Химическое равновесие смещено влево.
Среда кислотная, рН
Слайд 11
Соли, образованные слабой кислотой и слабым основанием.
NH4СН3СОО
+ H2O ↔ СН3СООН + NH3 · H2О
NH4СН3СОО ↔ NH4 + + СН3СОО¯Н2О ↔ OH¯ + H +
Ионное уравнение гидролиза:
NH4 + + СН3СОО¯ + Н2О ↔ NH3 · H2О + СН3СООН
рн = 7, среда нейтральная, гидролиз по
катиону и по аниону.
Слайд 12
Соли, образованные слабой кислотой и слабым основанием.
Гидролиз по
катиону и по аниону.
Химическое равновесие смещено вправо.
Реакция среды или
нейтральная, или слабокислая, или слабощелочная, что зависит от констант диссоциации кислоты и основания.Гидролиз может быть необратимым, если хотя бы один из продуктов реакции гидролиза уходит из сферы реакции.
Слайд 13
Соли, образованные сильной кислотой и сильным основанием.
КСl + H2O ↔
КСl ↔ К + + Сl¯
Н2О ↔ OH¯ + H +
Все ионы остаются в растворе – гидролиз не происходит. Среда нейтральная, рН =7, т.к.
концентрации катионов водорода и гидроксид - анионов в растворе равны, как в чистой воде.