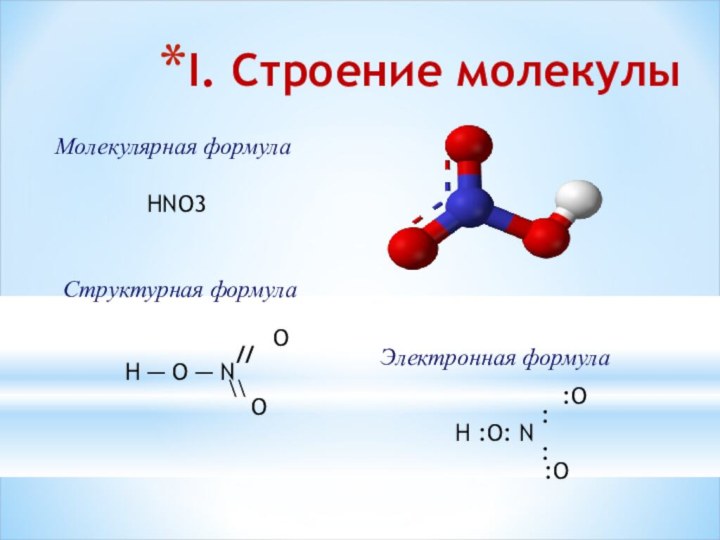
:O
:
H :O: N
:
:O
Структурная формула
O
//
H ─ O ─ N
\\
O
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть















Структурная формула
O
//
H ─ O ─ N
\\
O
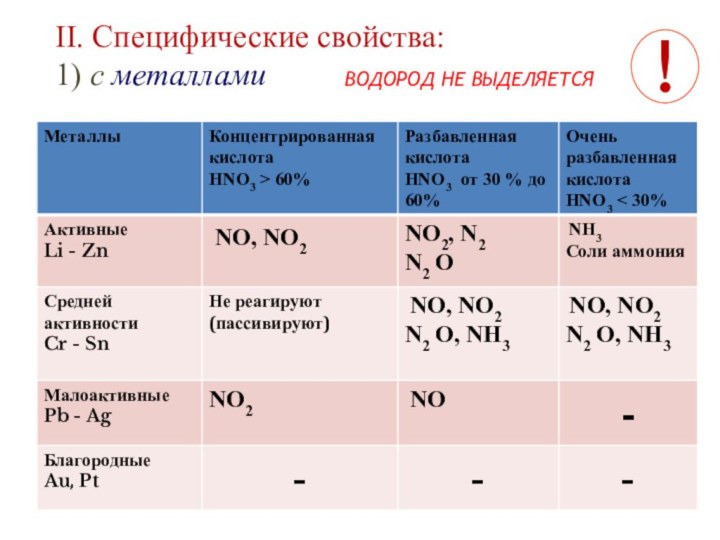
II. Характеристика кислоты
НNO3 ?
H+ + NO3-
Cu + HNO3 (конц) = Cu(NO3)2 + NO2 ↑ + 2H2O
Cu + 4HNO3 (конц) = Cu(NO3)2 + 2 NO2 ↑ + 2H2O
Zn + HNO3(разб) = Zn(NO3)2 + NH4NO3 + H2O
4Zn + 10HNO3(разб) = 4Zn(NO3)2 + NH4NO3 + 3H2O
4Zn + 10HNO3 (разбавл.)= 4Zn(NO3)2 + N2O + 5H2O
Ag + 2HNO3 (конц.)= AgNO3 + NO2 + H2O
Завод азотной кислоты
NaNO3 + H2SO4 = NaHSO4 + HNO3
Действием конц. серной
кислоты на нитрат натрия
(Лаборатория)
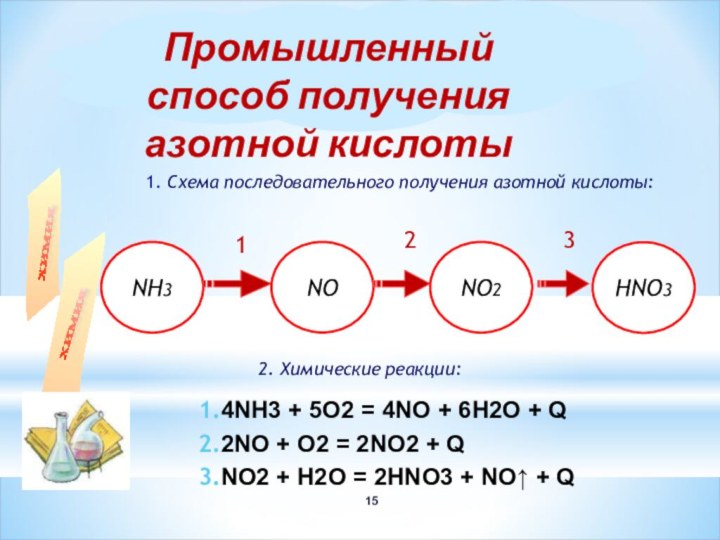
1
2
3
4NH3 + 5О2 = 4NO + 6Н2О + Q
2NO + O2 = 2NO2 + Q
NO2 + H2O = 2HNO3 + NO↑ + Q