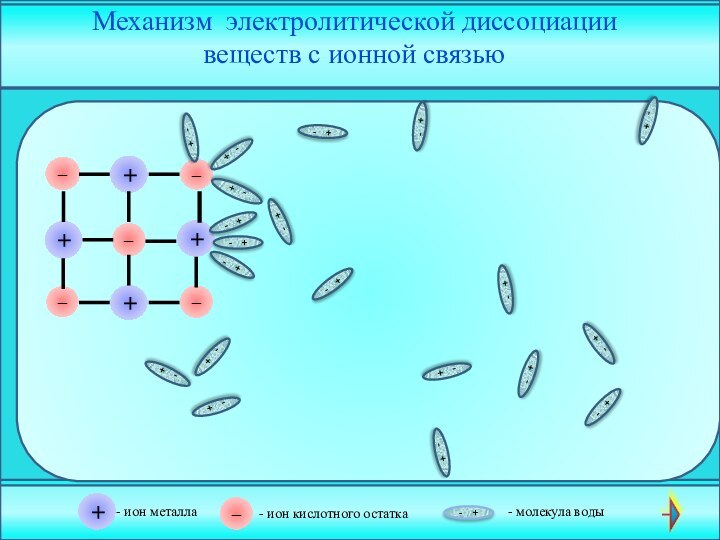
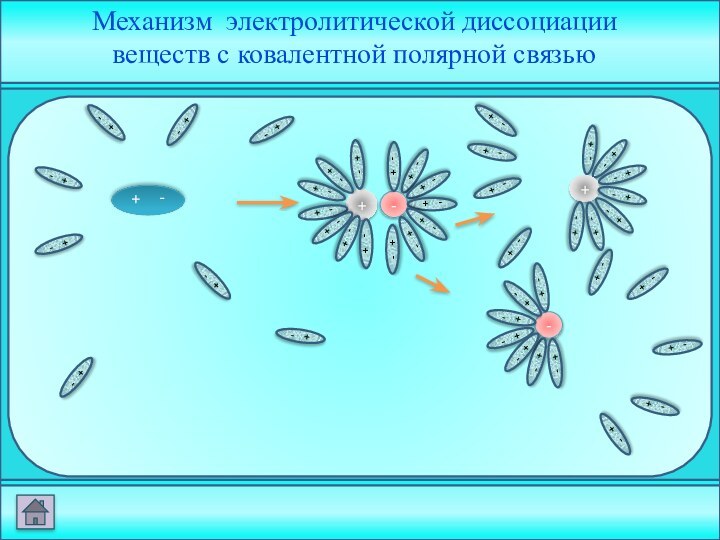
электролита на __________ .
Вопрос 1
электрического
тока
катализатора
молекул растворителя
температуры
Электролитическая диссоциация
электролитов в растворах протекает под действием __________ . Вопрос 2
Электролитическая диссоциация
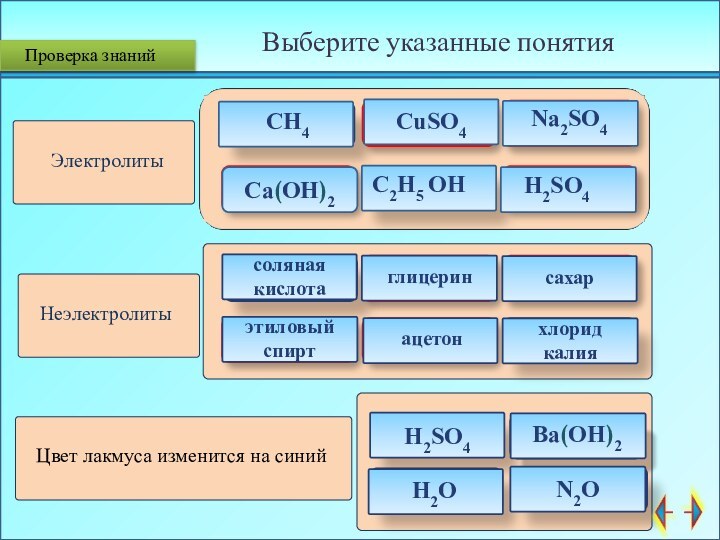
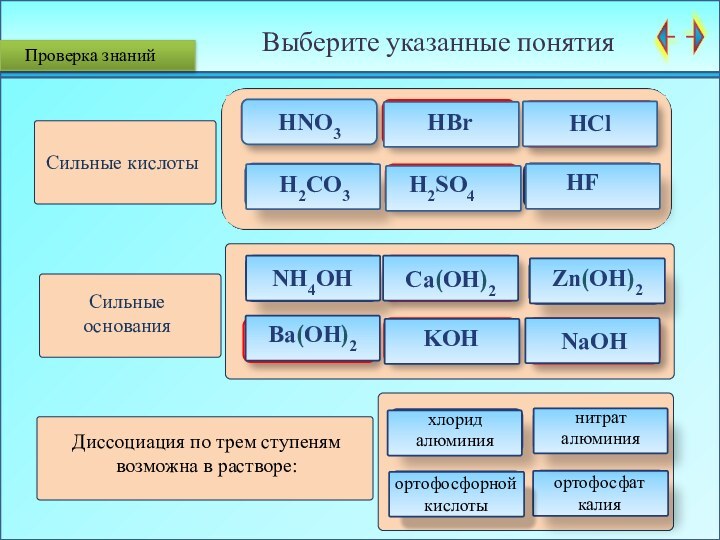
Проверка знаний

![Гидролиз солей Проверка знанийрН[H+][H+] ↔ [OH-]нейтральнаякислаящелочная[H+] = [OH-][H+] > [OH-][H+] < [OH-][H+]](/img/tmb/12/1117732/8e5e453fb59c7bbb526fc5488592731e-720x.jpg)