- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Кислоты
Содержание
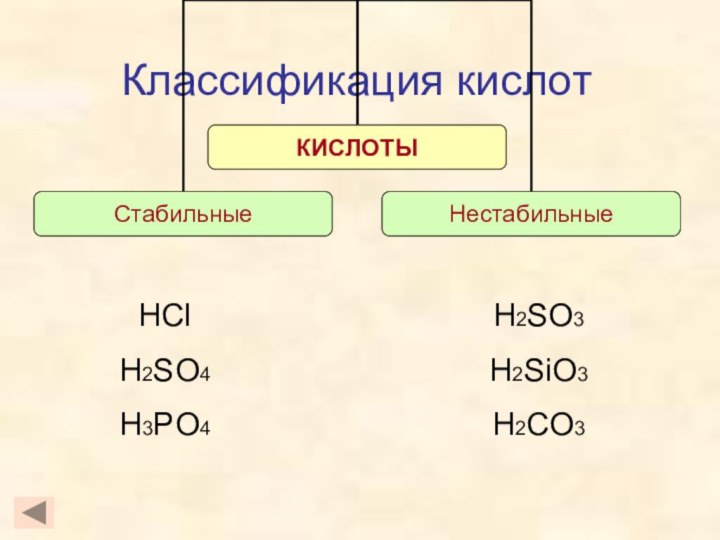
- 2. Кислоты – это эликтролиты, которые диссоциируют на катионы водорода и анионы кислотного остатка.
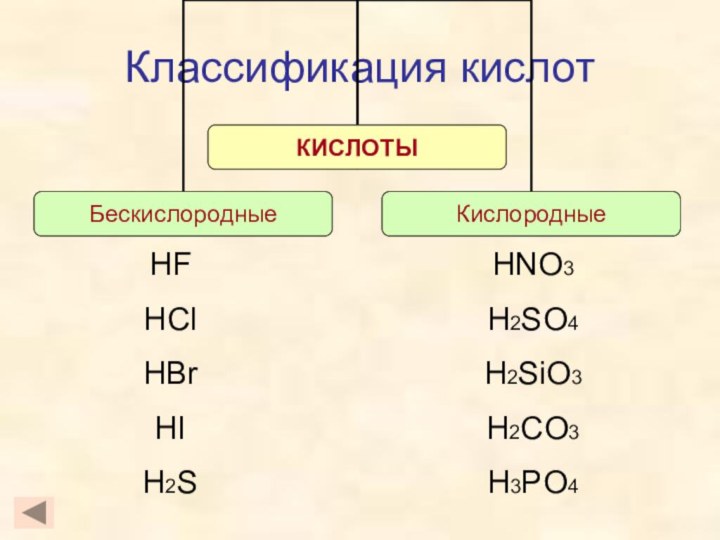
- 3. Классификация кислотHFHClHBrHIH2SHNO3H2SO4H2SiO3H2CO3H3PO4
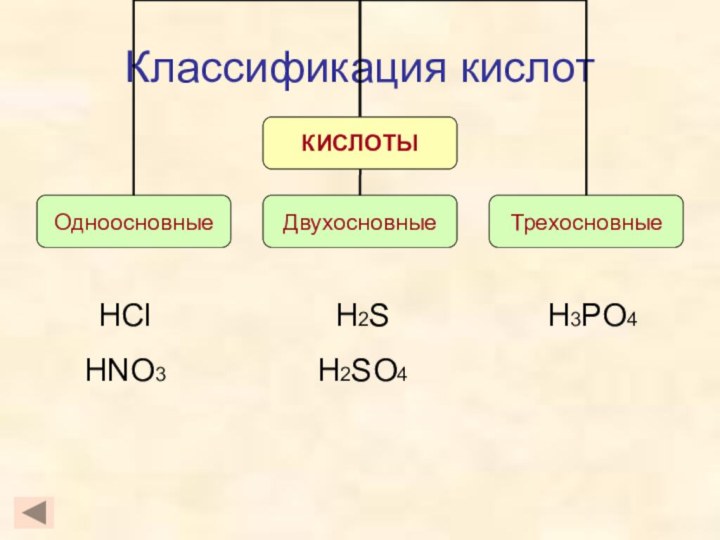
- 4. Классификация кислотHClHNO3H3PO4H2SH2SO4
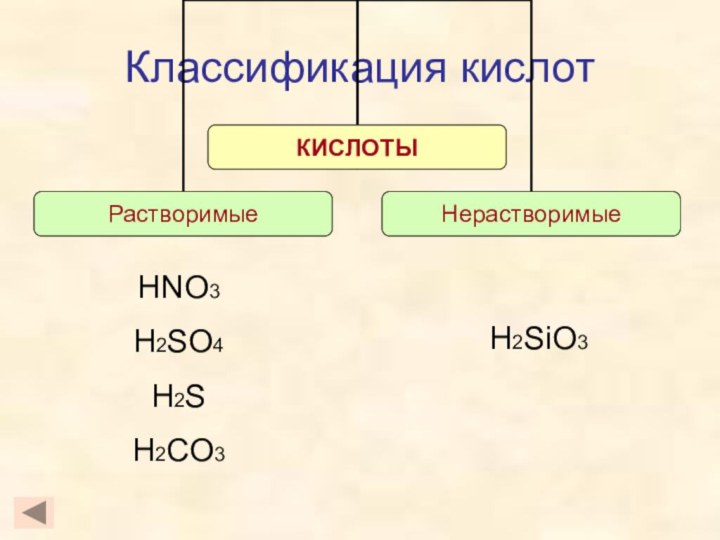
- 5. Классификация кислотH2SiO3HNO3H2SO4H2SH2CO3
- 6. Классификация кислотHClH2SO4H3PO4H2SO3H2SiO3H2CO3
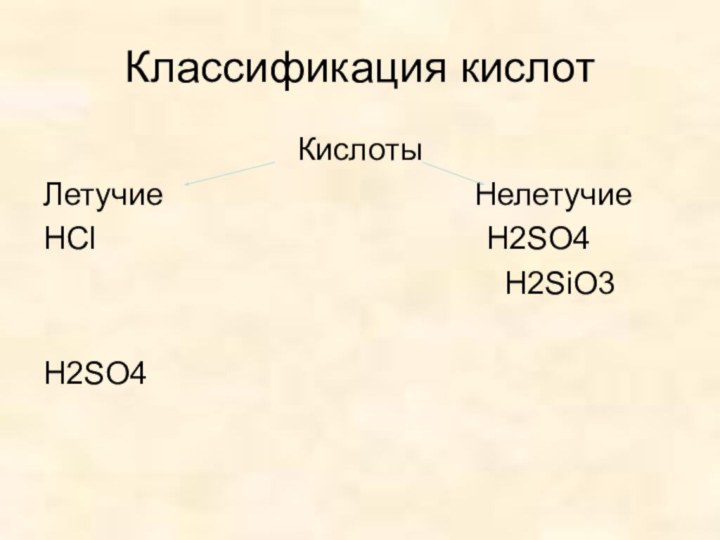
- 7. Классификация кислотКислоты Летучие
- 8. Классификация кислотСильные H2SO4HClHNO3СлабыеH2CO3H2S
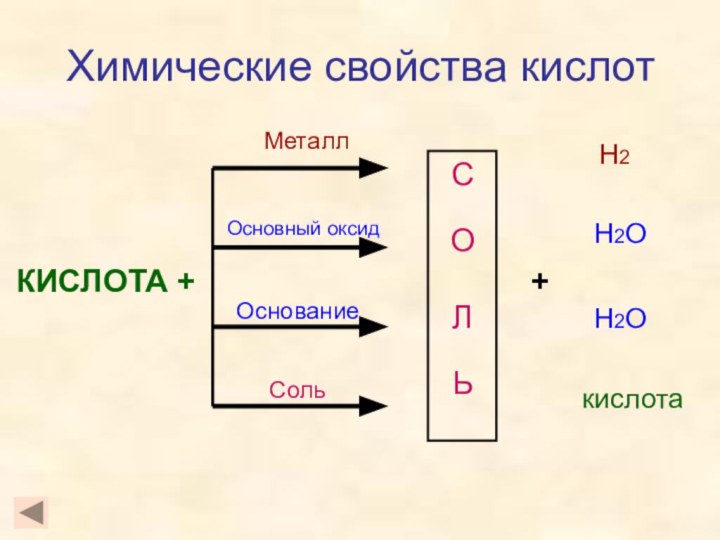
- 9. Химические свойства кислот КИСЛОТА +СОЛЬМеталлОсновный оксидОснованиеСоль+Н2Н2ОН2Окислота
- 10. Химические свойства кислотКислота + металл = соль
- 11. Химические свойства кислот Кислота + основный оксид = соль + водаСuO + H2SO4 =CuSO4 + H2O
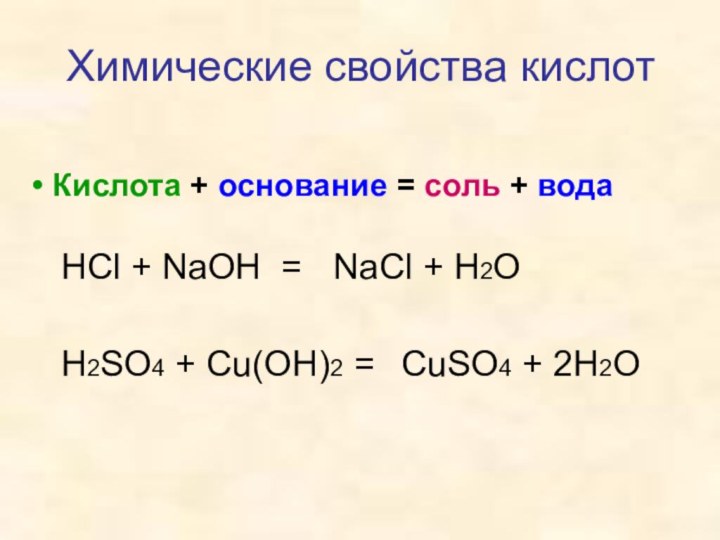
- 12. Кислота + основание = соль +
- 13. Химические свойства кислот Кислота 1 + соль
- 14. Способы получения кислотПолучение бескислородных кислотСинтез водородных соединений
- 15. Скачать презентацию
- 16. Похожие презентации
Кислоты – это эликтролиты, которые диссоциируют на катионы водорода и анионы кислотного остатка.








Слайд 2
Кислоты – это эликтролиты, которые диссоциируют на катионы
водорода и анионы кислотного остатка.
Слайд 10
Химические свойства кислот
Кислота + металл = соль +
водород
2HCl+Zn=ZnCl2+H2
Ряд активности металлов:
Li K Ba Ca Na Mg Al
Zn Fe Sn Pb H Cu Hg Ag Pt Au
Слайд 12
Кислота + основание = соль + вода
Химические
свойства кислот
HCl + NaOH =
H2SO4 + Cu(OH)2 =
NaCl +
H2OCuSO4 + 2H2O
Слайд 13
Химические свойства кислот
Кислота 1 + соль 1
= соль 2 + Кислота 2
Условия реакции:
1. Если образуется
осадок ↓:H2SO4 + BaCl2 =
BaSO4↓ + 2HCl
2. Если выделяется газ:
HNO3 + CaCO3 =
Ca(NO3)2 + H2O + CO2
2
Слайд 14
Способы получения кислот
Получение бескислородных кислот
Синтез водородных соединений неметаллов
из простых веществ с последующим растворением их в воде.
Н2+Cl2=2HCl2. Вытеснение галогеноводородов из твёрдых солей концентрированной серной кислотой.
NaCl+H2SO4= NaHS04+HCl