Слайд 2
Ойтүрткі:
Бұл металдан жасалған бірінші бұйым ХІХ ғасырдың 30
жылдарында Наполеон ІІІ арналған сылдырмақ ойыншық еді. Кейінірек Наполеон
ІІІ бұйрығы бойынша бұл медалдан асханалық ыдыстар жасалды, оларды императорға және құрметті қонақтарға ғана ұсынатын. Басқа қонақтар болса дәстүрлі металдар – алтын мен күмістен жасалған ыдыстар қолданылды. Бірте- бірте кезінде сирек кездесетін ғажайыптан бұл металл құрылысшылардың, архитекторлардың, дизайнерлердің ең қажетті материалына айналды. 1967 жылы американдық дизайнер Оскар де ла Рента көрермендерге осы металдың жіптерінен жасалған суға түсетін киім ұсынып сән әлемін таңғалдырды.
Ал ХХІ ғасыр осы металдың ғасырына айналды.
Слайд 4
Сабақтың мақсаты:
Білімділік: алюминийдің құрылысы, қосылыстары, физикалық, химиялық және
екідайлы қасиеттерімен, алу жолдарымен таныстыру.
Дамытушылық:оқушылардың жеке элемент туралы көзқарасын
дамыту, алюминий элементі туралы тарихи деректерге тоқталып, халықтық педагогика элементтерін сабақта пайдалану.
Тәрбиелілік: білімді , өз елінің ұлтын, халқын, тілін, байлығын сүйетін ұлтжанды, жастарды тәрбиелеу.
Слайд 5
Жоспар
Атом құрылысы
Табиғатта кездесуі
Физикалық қасиеттері
Химиялық қасиеттері
Өнеркәсіпте алынуы
Қолданылуы
Слайд 6
1.Химиялық таңбасы – Al
2.Реттік нөмірі – 13
3. Ar
(Al) - 27
4.Период нөмірі - III
5.Топ нөмірі – III
6.Ядро
заряды – 13
7.Электрон саны - 13
8.Валенттілігі – 3
9.Протон саны – 13
10.Нейтрон саны - 14
Слайд 7
Табиғатта кездесуі
1.Өзгемен салыстарғанда алатын орны- І
2.Өзге элементтермен салыстарғанда
алатын орны-ІІІ (O2,Si)
3.Алюмосиликаттар (Al, O2, Si, Сілті Me,Сілті.жер Me)
4.Каолинит
(H2O3· 2SiO2· 2H2O) саз балшық
5.Корунд (Al2O3) өте қатты, рубин(қызыл), аметист(күлгін),сапфир (көк)
6. Боксит (Al2O3 · nH2O)
7.Қазақстанда кездесетін кен орындары: Қостанай,Ақтөбе облыстарында
Рубин
Аметист Турмалин
Бирюза
Лазурит
Хризоберилл
Слайд 9
Сапфир
Сапфир (гр. sappheivos - көк тас) — Ті
мен Ғе қоспасы бар корундтың бір түрі. Электрондық аспап
жасауда қоспалар мөлшері шамамен 0,001% синтетикалық cапфир монокристалдары ("лейкосапфир") пайдаланылады. Сапфир инфрақызыл техниканың оптикалық элементтері мен аспаптарын, ИС пен гибридті ИС-дың төсеніштерін жасауда, сондай-ақ ШӨ пластиналарды өңдеуге арналған абразивті зат ретінде қолданылады.
Слайд 10
Александрит
Александрит – тотықтар класы, шпинельдер тобына жататын минерал;
хризоберилдің бір түрі. Химиялық формуласы ВеAl2O4. Құрамында 1%-ға дейін
Cr2O3 болады. Кристалдары тақта тәрізді келеді. Түсі күн сәулесінде жасыл, жасанды жарықта күлгін қызыл. Қаттылығы 8,5; меншікті салмағы 3,7 г/см3. Александрит гранит пегматиттерінде, түрлі құрамды грейзендерде, карбонатиттерде және осылардан түзілген қайраң-дарда кездеседі. Салмағы 2 – 3 караттан жоғары, бояуы қанық мөлдір кристалдары 1-кластық асыл тас ретінде бағаланады.
Слайд 11
Рубин
Рубин - латынша rubens, rubinus - қызыл
деген мағынаны білдіреді. Al2O3 минералы, корунд сыныбына жатады. Қаттылығы
- Моос шкаласы бойынша - 9, тығыздығы 3, 97 - 4,05 г/см аралығында. Қызыл шпинелден кристалдарының формасына қарап айырамыз, кейбір жағдайларда микроскоп арқылы ғана айырып білуге болады. Қызыл түске ие болуының себебі - құрамында хромның қоспасы бар. Қызыл корундтар - рубин(лағыл) деп аталса, көктері - сапфирлер делінеді. Ашық боялған сапфирлар мен түссiз корундтарды "лейкосапфирлер" деп аталады. Астеризм эффектісі анық байқалатын "жұлдызша сапфирлері" кабошон түрінде өңделеді.
Наным-сенімдер Лағылдар ертеректе "өмiр және махаббаттар тасы" деп есептелінді. Мұндай тасқа иелік еткен адам ерекше қадір-қасиетке ие болған. Лағылдармен оба секілді түрлі аурулардан қорғануға тырысқан. Лағыл тастар астрологияда мергендердің, шаяндардың және тауешкі, тоқты, арыстандардың тасы болып есептелінеді.
Слайд 12
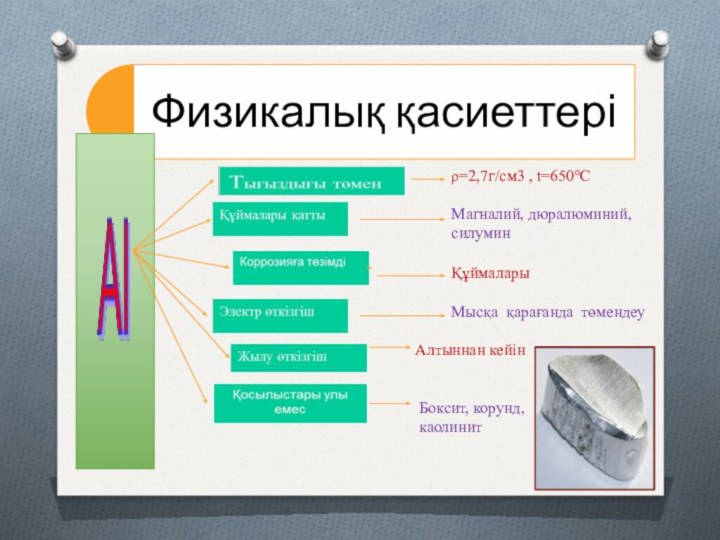
ρ=2,7г/см3 , t=650°С
Магналий, дюралюминий,
силумин
Құймалары
Мысқа қарағанда төмендеу
Алтыннан кейін
Боксит, корунд,
каолинит
Слайд 13
Жай заттармен әрекеттесуі
2 A1 + 3 C12 =
2A1 C13;
2 A1 + 3 S =
A12 S3;
2 A1 + N2 = 2 A1 N;
4 A1 + 3 C = A14C3
Күрделі заттармен әрекеттесуі
2A1 + 6H20 = 2A1(0H)3 + 3H2
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
2Al + 3 CuCl2= 2AlCl3+ 3Cu
Алюминий қосылыстары
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Al(OH)3 + 6HCl = 2AlCl3 + 6H2O
Al(OH)3 + NaOН = NaAlO2 + 2H2O
Аl2O3 + 6HCl = 2AlCl3 + 3H2O
Al(OH)3 + 3HCl = Al Cl3 + 3H2O
Слайд 14
Реактивтерді қолмен ұстауға, дәмін татып көруге болмайды.
Тәжірибеге қажетті
заттарды мүмкіндігінше дәл мөлшерде және аз етіп алыңдар.
Қышқылдармен сілтілермен
жұмыс істегенде абай болыңдар.
Жұмыс соңында қолданылған құрал-жабдықты, реактивтерді өз орнына қою керек.
Слайд 15
5- зертханалық тәжірибе
Алюминий гидроксидінің қышқыл және сілті ерітінділерімен
әрекеттесуі
Тапсырма. Алюминий гидроксидін алыңдар және оған тән химиялық қасиеттерін
зерттеңдер.
1-тәжірибе. Сынауыққа алюминий тұзының 2 мл ерітіндісін құйып, оған қоймалжың тұнба түзілгенше натрий гидроксидінің ерітіндісін тамшылатып құйыңдар. Түзілген алюминий гидроксидіне зер салыңдар.
2-тәжірибе. Тұнбаның жартысын басқа сынауыққа құйыңдар.
3-тәжірибе. Тұнбаның бір бөлігіне толық ерігенше қышқыл ерітіндісін құйыңдар.
4-тәжірибе. Тұнбаның екінші бөлігіне сынауықты шайқай отырып, тұнба толық ерігенше сілті ерітіндісін құйыңдар
Слайд 16
1- тәжірибе.
AlCІ3 +3NaOH= AІ(OH)3 +3NaCІ
3-тәжірибе.
AІ(OH)3 +3HCІ= AlCІ3 +3H2
O
4-тәжірибе.
AІ(OH)3 +NaOH= NaAlO2 +2H2O
электр
тогы
2АІ2О3 → 4АІ + 3О2 - 3352кДж
2007 жылдан бері Қазақстанда алюминий алатын Павлодар электролиз заводы жұмыс істеп келеді.
Слайд 20
Төмендегі қосылыстардың ішінен алюминийдің табиғи қосылыстары
Мәрмәр,гипс,корунд,пирит,флюрит,боксит, алмаз,
ортоклаз,графит, каолинит.
1. Алюминий табиғи қосылыстары
2. Формуласын жазыңыз
3. Элементтердің
массалық үлесін есепте
Слайд 21
1. Электронды баланс әдісімен химиялық реакцияны теңестір :
а)
Al + H2SO4= Al2(SO4)3 + SO2 + H2O
ә) Al
+ HNO3 = Al(NO3)3 + NO2 + H2O
2. Массасы 12 г алюминий мен мыс қоспасы тұз қышқылымен өңделді. Бөлініп шыққан сутек 7,4 л көлем алынды. Әр металдың қоспадағы массалық үлесін есепте.
Слайд 22
Тест сұрақтары
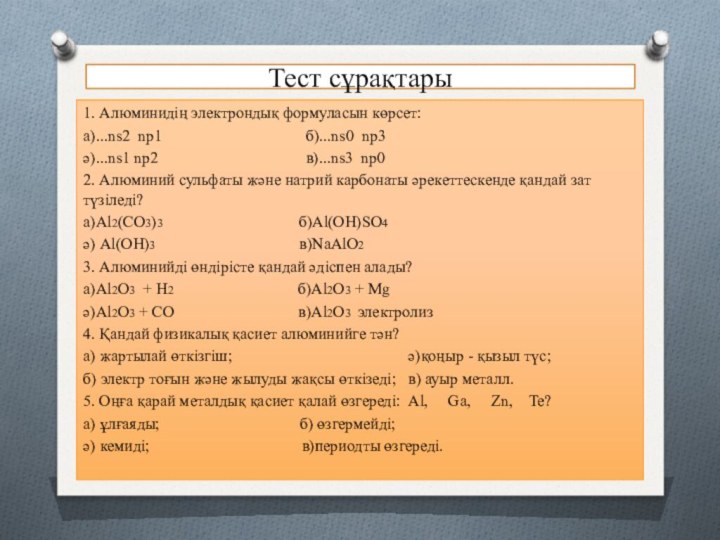
1. Алюминидің электрондық формуласын көрсет:
а)...ns2 nр1
б)...ns0 nр3
ә)...ns1 nр2 в)...ns3 nр0
2. Алюминий сульфаты және натрий карбонаты әрекеттескенде қандай зат түзіледі?
а)Аl2(СО3)3 б)Аl(ОН)SО4
ә) Аl(ОН)3 в)NaАlО2
3. Алюминийді өндірісте қандай әдіспен алады?
а)Al2O3 + H2 б)Al2O3 + Mg
ә)Al2O3 + CO в)Al2O3 электролиз
4. Қандай физикалық қасиет алюминийге тән?
а) жартылай өткізгіш; ә)қоңыр - қызыл түс;
б) электр тоғын және жылуды жақсы өткізеді; в) ауыр металл.
5. Оңға қарай металдық қасиет қалай өзгереді: Al, Ga, Zn, Te?
а) ұлғаяды; б) өзгермейді;
ә) кемиді; в)периодты өзгереді.
Слайд 23
6. Қандай реакциядан сутек газы бөлінеді?
а) Al +
H2
б) Al + NaOH
ә) Al + HNO3(конц) в) Al + H2SO4(конц)
7. Қандай тұз ерітіндіде толық гидролизденеді?
а) Al2(SO4)3 б) AlCl3
ә) Al(NO3)3 в) Al2S3
8. Al2O3 -ті электролиздегенде криолит (Na3AlҒ6) не үшін қолданылады?
а) электрөткізгіштігін күшейтуге ә) тез балқытуға
б) Al2O3 -тің балқу температурасын төмендетуге
в) электрөткізгіштігін төмендетуге
9. Аl(ОН)3 + 2НСІ реакция нәтижесінде қандай тұз түзіледі?
а) Al(OH)2Cl б) Al(OH)3Cl
ә) Al(OH)Cl2 в) AlCl3
10. 0,2 моль алюминий тұз қышқылымен әрекеттескенде бөлінген сутектің зат мөлшері
а) 0,2 моль; б) 0,4 моль;
ә)0,3 моль; в) 0,5 моль.
Атом құрылысы
Табиғатта кездесуі
Физикалық қасиеті
Химиялық қасиеті
Өнеркәсіпте алынуы
Қолданылуы