- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химическая связь
Содержание
- 2. СТРОЕНИЕ АТОМАХИМИЧЕСКАЯ СВЯЗЬ
- 3. Студент должен:Знать:Положения теории химической связи, виды и
- 4. Учение о химической связи составляет основу всей
- 5. К основным чертам химической связи можно отнести: а)
- 6. Различают четыре типа химических связей: ионную, ковалентную,
- 7. Ионная химическая связь-это
- 8. Атомы, присоединившие «чужие» электроны, превращаются в отрицательные
- 9. →Схема образования ионной связи во фториде натрия:
- 10. Два разноименно заряженных иона, связанные силами притяжения,
- 11. В ионном соединении ионы представлены как бы
- 13. Ионная связь существует также в солях аммония,
- 14. Ковалентная химическая связь-это связь, возникающая между атомами
- 15. Обменный механизм действует, когда атомы образуют общие
- 16. 2)HCl- хлороводород:
- 17. 3) Cl2- в молекуле хлора ковалентная связь
- 18. 4)N2- в молекуле азота между атомами образуются
- 19. Донорно-акцепторный механизм образования ковалентной связи рассмотрим на
- 20. Ковалентные связи классифицируют не только по механизму
- 21. Две другие общие электронные пары образуются за
- 22. Следовательно, σ-связи могут образовываться за счет перекрывания
- 23. 2)двойные:
- 24. Например:
- 25. Азот- более электроотрицательный элемент, чем водород, поэтому
- 26. полярными, а молекула не будет полярной, так
- 27. молекулярной- в обычных условиях это газы, легколетучие
- 28. Связь в металлах и сплавах, которую выполняют
- 29. Наличием металлической связи обусловлены физические свойства металлов
- 30. Химическую связь между положительно поляризованными атомами водорода
- 31. При наличии такой связи даже низкомолекулярные вещества
- 32. При этом действует принцип комплиментарности, то есть
- 33. Деление химических связей на типы носит условный
- 34. В ряду галогеноводородов HF-HCL-HBr-HI-HAt степень полярности связи
- 35. 3)В солях аммония, метиламмония и т.д.-между атомами
- 36. Причиной единства всех типов и видов химических
- 37. Скачать презентацию
- 38. Похожие презентации
СТРОЕНИЕ АТОМАХИМИЧЕСКАЯ СВЯЗЬ

































Слайд 4 Учение о химической связи составляет основу всей теоретической
химии.
Фундаментальной основой химической связи явилась теория химического строения А.М.
Бутлерова (1861 г.), согласно которой свойства соединений зависят от природы и числа составляющих их частиц и химического строения. Эта теория нашла подтверждение не только для органических, но и неорганических веществ, поэтому ее следует считать фундаментальной теорией химии.Под химической связью понимаются различные виды взаимодействий, обуславливающие устойчивое существование двух- и многоатомных соединений: молекул, ионов, кристаллических и иных веществ.
Слайд 5
К основным чертам химической связи можно отнести:
а) снижение
общей энергии двух- или многоатомной системы по сравнению с
суммарной энергией изолированных частиц, из которых эта система образована;б) перераспределение электронной плотности в области химической связи по сравнению с простым наложением электронных плотностей несвязанных атомов, сближенных на расстояние связи.
По своей природе химическая связь представляет собой взаимодействие между положительно заряженными ядрами и отрицательно заряженными электронами, а так же электронов друг с другом.
Слайд 6 Различают четыре типа химических связей: ионную, ковалентную, металлическую
и водородную.
Правило октета. В результате образования химической связи атомы
могут приобретать такую же электронную конфигурацию, как у благородных газов, которые (за исключением гелия) имеют на внешней оболочке восемь (октет) электронов. Стремление к созданию такой устойчивой электронной конфигурации получило название правило октета. Это справедливо как для ионной, так и ковалентной связей.Слайд 7 Ионная химическая связь-это связь,
образовавшаяся за счет электростатического притяжения катионов к анионам.
Как вы
знаете, наиболее устойчивой является такая электронная конфигурация атомов, при которой на внешнем электронном уровне, подобно атомам благородных газов , будут находиться 8 электронов ( или для первого энергетического уровня-2). При химическом взаимодействии атомы стремятся приобрести именно такую устойчивую электронную конфигурацию и часто достигают этого или в результате присоединения валентных электронов от других атомов (процесса восстановления), или в результате отдачи своих валентных электронов (процесса окисления).
Слайд 8 Атомы, присоединившие «чужие» электроны, превращаются в отрицательные ионы,
или анионы. Атомы, отдавшие свои электроны, превращаются в положительные
ионы, или катионы. Понятно, что между анионами и катионами возникают силы электростатического притяжения, которые и будут удерживать их друг около друга, осуществляя тем самым ионную химическую связь.Так как катионы образуют в основном атомы металлов, а анионы –атомы неметаллов, логично сделать вывод, что этот тип связи характерен для соединений типичных металлов (элементы главных подгрупп I и II групп, кроме магния Mg и бериллия Be) c типичными неметаллами (элементами главной подгруппы VII группы). Классическим примером является образование галогенидов щелочных металлов (фторидов, хлоридов и др.).
Слайд 10 Два разноименно заряженных иона, связанные силами притяжения, не
теряют способности взаимодействовать с противоположно заряженными ионами, вследствие чего
образуются соединения с ионной кристаллической решеткой. Ионные соединения представляют собой твердые, прочные, тугоплавкие вещества с высокой температурой плавления.Растворы и расплавы большинства ионных соединений –электролиты. Такой тип связи характерен для гидроксидов типичных металлов и многих солей кислородосодержащих кислот. Однако при образовании ионной связи не происходит идеального (полного) перехода электронов. Ионная связь является крайним случаем ковалентной полярной связи.
Слайд 11 В ионном соединении ионы представлены как бы в
виде электрических зарядов со сферической симметрией электрического поля ,
одинаково убывающего с увеличением расстояния от центра заряда (иона) в любом направлении.Поэтому взаимодействие ионов не зависит от направления, то есть ионная связь, в отличие от ковалентной, будет ненаправленной.
Слайд 13 Ионная связь существует также в солях аммония, где
нет атомов металлов (их роль играет катион аммония
) –, , и в солях, образованных органическими основаниями- аминами (например, в хлориде метиламмония –
и т.д.).
Слайд 14 Ковалентная химическая связь-это связь, возникающая между атомами за
счет образования общих электронных пар.
В основе ее описания также
лежит представление о приобретении атомами химических элементов энергетически выгодной и устойчивой электронной конфигурации из восьми электронов ( для атома водорода из двух). Такую конфигурацию атомы получают не путем отдачи или присоединения электронов, как в случае ионной связи, а посредством образования общих электронных пар. Механизм образования такой связи может быть обменный или донорно-акцепторный.Слайд 15 Обменный механизм действует, когда атомы образуют общие электронные
пары за счет объединения неспаренных электронов.
Например:
1) Н2-водород:
1Н
H∙+∙H→H(:)H или Н−Н1S
Связь возникает благодаря образованию общей электронной пары s-электронами атомов водорода (перекрыванию s-орбиталей):
+ =
s s s−s
Слайд 16
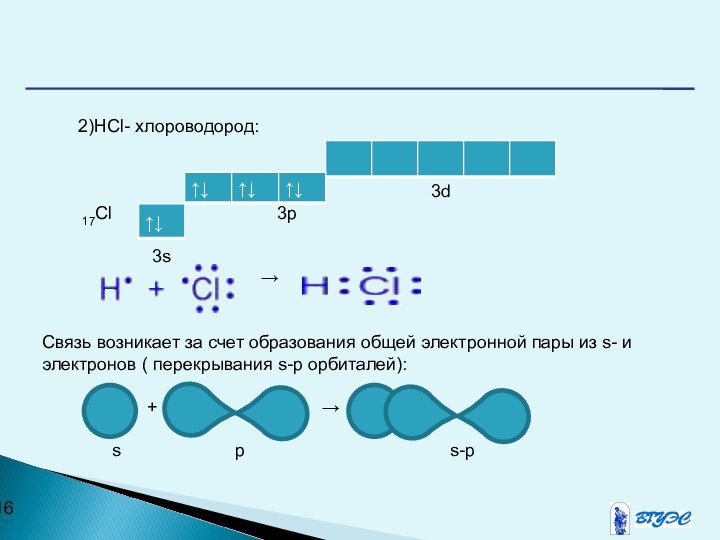
2)HCl- хлороводород:
3d
17Cl 3p
3s
→
Связь возникает за счет образования общей электронной пары из s- и электронов ( перекрывания s-р орбиталей):
+ →
s р s-р
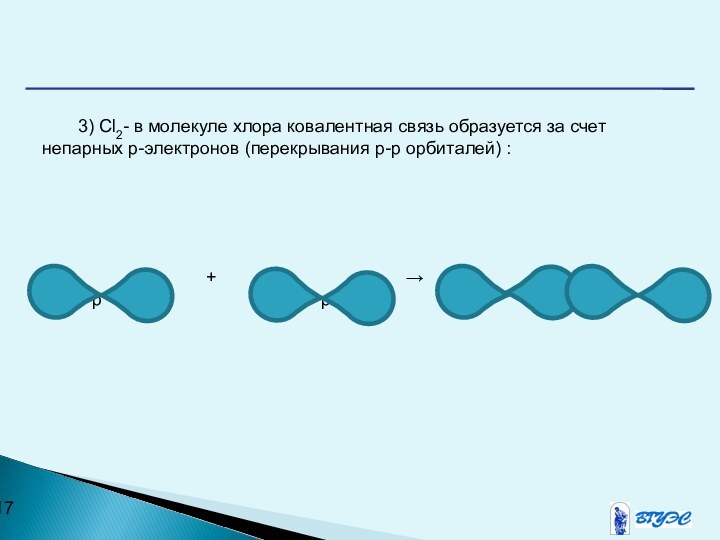
Слайд 17 3) Cl2- в молекуле хлора ковалентная связь образуется
за счет непарных р-электронов (перекрывания р-р орбиталей) :
+ →р р р-р
Слайд 19 Донорно-акцепторный механизм образования ковалентной связи рассмотрим на классическом
примере образования иона аммония
:→
Донор имеет электронную пару, акцептор- свободную орбиталь, которую эта пара может занять. В ионе аммония все четыре связи с атомами водорода ковалентные: три образовались благодаря созданию общих электронных пар атомом азота и атомами водорода по обменному механизму, одна образовалась по донорно- акцепторному механизму. Все четыре связи N-H в катионе аммония равноценны.
Аналогично образуется донорно-акцепторная связь в ионе метиламмония
Слайд 20 Ковалентные связи классифицируют не только по механизму образования
общих электронных пар, соединяющих атомы, но и по способу
перекрывания электронных орбиталей, по числу общих электронных пар, а также по смещению их к одному из связанных атомов.По способу перекрывания электронных орбиталей различают π- и σ-ковалентные связи (пи- и сигма)
В молекуле азота одна общая электронная пара образуется за счет σ-связи (электронная плотность находится в одной области, расположенной на линии, соединяющей ядра атомов; связь прочная).
р-р
σ-связь
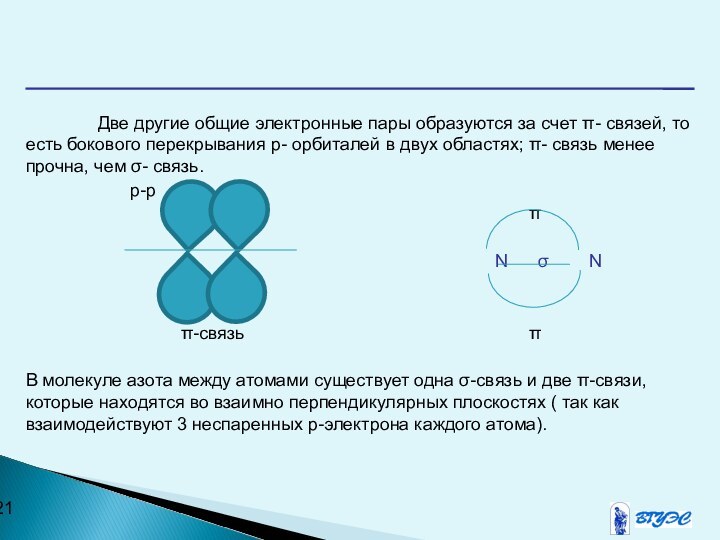
Слайд 21 Две другие общие электронные пары образуются за счет
π- связей, то есть бокового перекрывания р- орбиталей в
двух областях; π- связь менее прочна, чем σ- связь.p-p
π
N σ N
π-связь π
В молекуле азота между атомами существует одна σ-связь и две π-связи, которые находятся во взаимно перпендикулярных плоскостях ( так как взаимодействуют 3 неспаренных р-электрона каждого атома).
Слайд 22 Следовательно, σ-связи могут образовываться за счет перекрывания электронных
орбиталей:
s-s (H2)
s-p (HCl)
p-p (Cl2),
а также за счет
перекрывания «чистых» и гибридных орбиталей:s-sp3 (CH4),
sp2-sp2 (C2H4) и т.д.
По числу общих электронных пар, связывающих атомы, то есть по кратности, различают ковалентные связи:
1) одинарные: СН4-метан
Н2 -водород Н
Н─Н │
Н ─ С ─ Н
│
Н
Слайд 23
2)двойные:
СО2
C2H4О═С═О H2C═CH2
оксид углерода (IV) этилен
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть неполярной и полярной. При неполярной ковалентной связи общие электронные пары не смещены ни к одному из атомов, так как эти атомы имеют одинаковую электроотрицательность (ЭО)- свойство оттягивать к себе валентные электроны от других атомов.
Ковалентную химическую связь, образующуюся между атомами с одинаковой электроотрицательностью, называют неполярной.
Слайд 24
Например:
или N2
то есть посредством ковалентной неполярной связи образованы молекулы простых веществ-неметаллов.
Значения относительной электроотрицвтельности фосфора и водорода практически одинаковы: ЭО (Н)=2,1; ЭО (Р)=2,1, поэтому в молекуле фосфина РН3 связи между атомом фосфора и атомами водорода ковалентные неполярные.
Ковалентную химическую связь между атомами элементов, электроотрицательности которых различаются, называют полярной.
Например: NH3- аммиак
Слайд 25 Азот- более электроотрицательный элемент, чем водород, поэтому общие
электронные пары смещаются к его атому.
H→ N ← H↑
H
В метаноле CH3OH:
H
↓
H→ C → O ← H
↑
H
ЭО (О)>ЭО(С)>ЭО(Н)
Следует различать полярность молекулы о полярность связи. Полярность связи зависит от значений электроотрицательности связанных атомов, а полярность молекулы зависит и от полярности связи, и от геометрии молекулы. Например, связи в молекуле углекислого газа СО2
Слайд 26 полярными, а молекула не будет полярной, так как
имеет линейное строение.
Молекула воды Н2О полярна, так как образована
с помощью двух ковалентных полярных связей Н→О и имеет угловую форму. Валентный угол НОН составляет 104,5о , поэтому у атома кислорода с частичным отрицательным зарядом δ- и двумя неподеленными электронными парами формируется отрицательный полюс молекулы, а у атомов водорода с зарядом δ+ -положительный. Молекула воды- диполь.Оδ-
Н δ+ Нδ+
Вещества с ковалентной связью характеризуются кристаллической решеткой двух типов:
атомной- очень прочной (алмаз, графит, кварц);
Слайд 27 молекулярной- в обычных условиях это газы, легколетучие жидкости
и твердые, но легкоплавкие или возгоняющиеся вещества (Cl2, H2O,
«сухой лед» и др.).Внутримолекулярная ковалентная связь прочная, но межмолекулярное взаимодействие очень слабое, вследствие чего молекулярная кристаллическая решетка непрочная.
Слайд 28 Связь в металлах и сплавах, которую выполняют относительно
свободные электроны между ионами металлов в металлической кристаллической решетке,
называют металлической.Такая связь ненаправленная, ненасыщенная, характеризуется небольшим числом валентных электронов и большим числом свободных орбиталей, что характерно для атомов металлов.
Схема образования металлической связи:
М0-ne- ↔ Mn+
Слайд 29 Наличием металлической связи обусловлены физические свойства металлов и
сплавов: твердость, электрическая проводимость и теплопроводность, ковкость, пластичность, металлический
блеск.Вещества с металлической связью имеют металлическую кристаллическую решетку. В ее узлах находятся ионы или атомы металла, между которыми свободно ( в пределах кристалла) перемещаются электроны («электронный газ»).
Слайд 30 Химическую связь между положительно поляризованными атомами водорода одной
молекулы (или ее части) и отрицательно поляризованными атомами сильно
электроотрицательных элементов, имеющих неопределенные электронные пары (F,O,N и реже Cl и S) другой молекулы (или ее части), называют водородной.Механизм образования водородной связи имеет частично электростатический, частично донорно-акцепторный характер. Пример межмолекулярной водородной связи:
…Оδ-−Нδ+… Оδ-−Нδ+… вода
│ │
Нδ+ Нδ+
Слайд 31 При наличии такой связи даже низкомолекулярные вещества могут
быть при обычных условиях жидкостями (спирт, вода) или легко
сжижающимися газами (аммиак, фтороводород).В биополимерах-белках (вторичная структура) имеется внутримолекулярная водородная связь между карбонильным кислородом и водородом аминогруппы:
С═Оδ-…δ+Н─N
Молекулы полинуклеотидов- ДНК (дезоксирибонуклеотиновая кислота) представляют собой двойные спирали, в которых две цепи нуклеотидов связаны друг с другом водородными связями.
Слайд 32 При этом действует принцип комплиментарности, то есть эти
связи образуются между определенными парами, состоящими из пуринового и
пиримидинового оснований: против аденинового нуклеотида (А) располагается тиминовый (Т), а против гуанинового (Г)- цитозиновый (Ц). Вещества с водородной связью имеют молекулярные кристаллические решетки.Слайд 33 Деление химических связей на типы носит условный характер,
так как все они характеризуются определенным единством.
Ионную связь можно
рассматривать как предельный случай ковалентной полярной связи.Металлическая связь совмещает ковалентное взаимодействие атомов с помощью обобществленных электронов и электростатическое притяжение между этими электронами и ионами металлов.
В веществах часто отсутствуют предельные случаи химической связи (или «чистые» химические связи).
Например, фторид лития LiF относят к ионным соединениям. Фактически же в нем связь на 80% ионная и на 20% ковалентная. Правильнее поэтому, очевидно, говорить о степени полярности (ионности) химической связи.
Слайд 34 В ряду галогеноводородов HF-HCL-HBr-HI-HAt степень полярности связи уменьшается
, ибо уменьшается разность в значениях электроотрицательности атомов галогена
и водорода, и в астатоводороде связь становится почти неполярной (ЭО(Н)=2,1; ЭО (At) =2,2).Различные типы связей могут содержаться в одних и тех же веществах, например:
в основаниях-между атомами кислорода и водорода в гидроксогруппах связь ковалентная полярная, а между металлом и гидроксогруппой- ионная;
в солях кислородосодержащих кислот- между атомами неметалла и кислородом кислородного остатка- ковалентная полярная , а между металлом и кислородным остатком- ионная;
Слайд 35 3)В солях аммония, метиламмония и т.д.-между атомами азота
и водорода- ковалентная полярная, а между ионами аммония или
метиламмония и кислородным остатком-ионная;4) в пероксидах металлов (например, Na2O2) –связь между атомами кислорода ковалентная неполярная, а между металлом и кислородом- ионная и т.д.
Различные типы связей могут переходить одна в другую:
при электролитической диссоциации в воде ковалентных соединений ковалентная полярная связь переходит в ионную;
при испарении металлов металлическая связь превращается в ковалентную неполярную и т.д.