- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химические свойства бензола
Содержание
- 2. Химические свойства бензола определяются строением его молекулы.
- 3. Нитрование. При действии на бензол смеси концентрированных
- 4. Галогенирование (хлорирование, бромирование, иодирование) осуществляется в присутствии
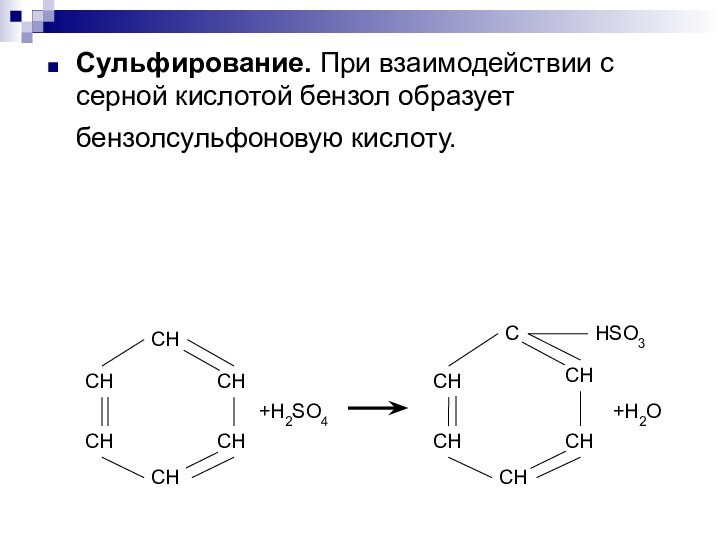
- 5. Сульфирование. При взаимодействии с серной кислотой бензол образует бензолсульфоновую кислоту.
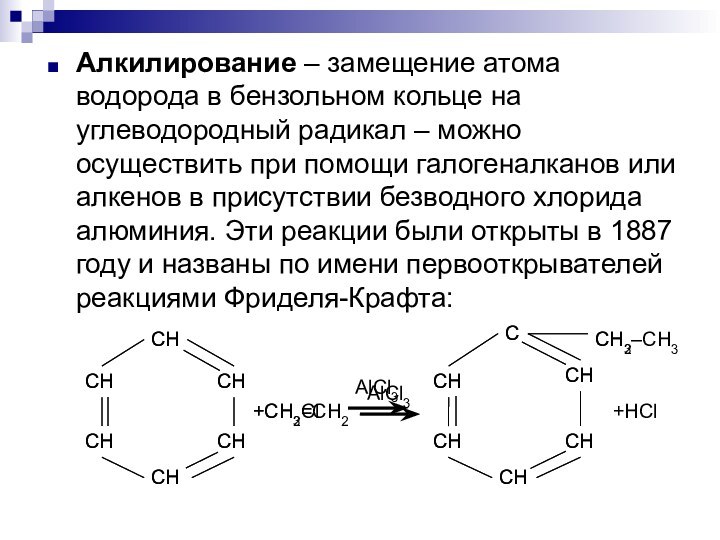
- 6. Алкилирование – замещение атома водорода в бензольном
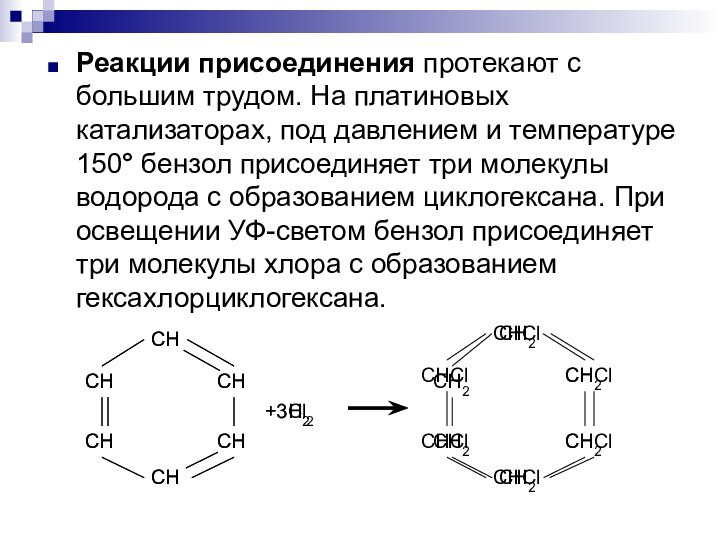
- 7. Реакции присоединения протекают с большим трудом. На
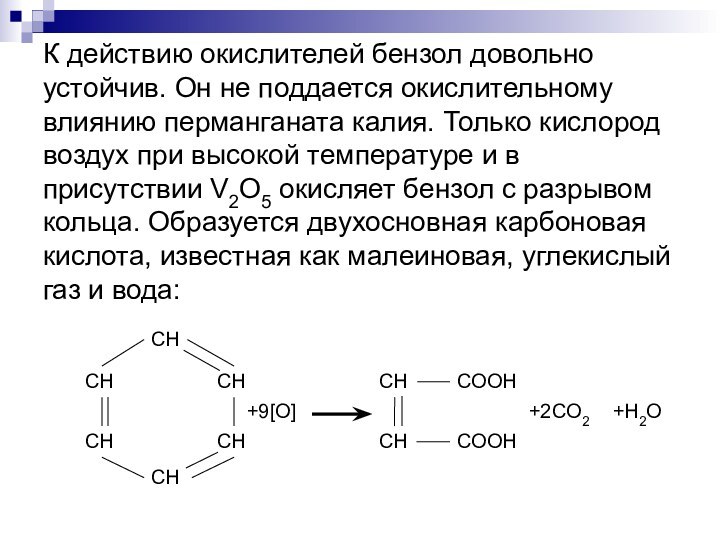
- 8. К действию окислителей бензол довольно устойчив. Он
- 9. На воздухе бензол горит коптящим пламенем 2С6Н6 + 15О2 = 12СО2+ 6Н2О
- 10. Реакции замещения после введения в бензольное ядро
- 11. Заместители первого рода (-CH3, -CH2R, -CHR2, CR3,
- 12. Заместители второго рода (-HSO3, -NO2, -CHO, -COOH,
- 13. Сила заместителей первого рода –OH > –NH2
- 14. ЗАКРЕПЛЕНИЕ ПРОЙДЕННОГО МАТЕРИАЛА:1. Запишите реакции нитрования и
- 15. РЕШЕНИЕ РАСЧЕТНЫХ ЗАДАЧ:Для сжигания ароматического углеводорода массой
- 16. Скачать презентацию
- 17. Похожие презентации
Химические свойства бензола определяются строением его молекулы. Образование сопряженной π-электронной системы сопровождается выделением 150кДж энергии. Это так называемая энергия стабилизации, благодаря которой ароматические системы обладают повышенной устойчивостью.


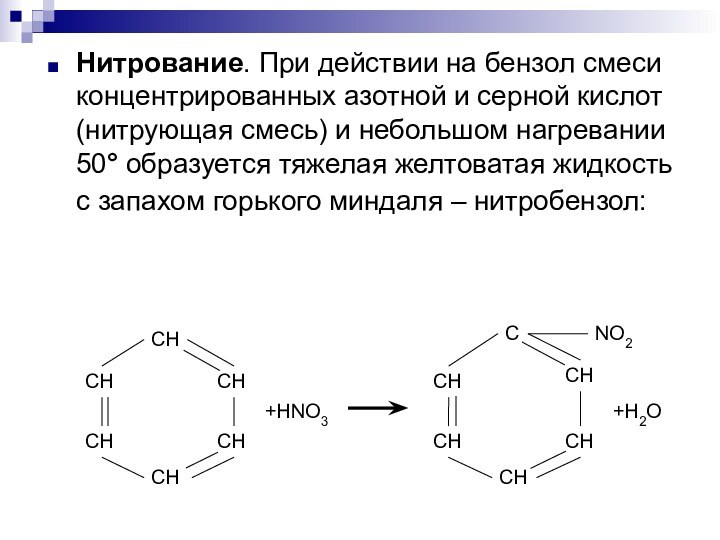





Слайд 3 Нитрование. При действии на бензол смеси концентрированных азотной
и серной кислот (нитрующая смесь) и небольшом нагревании 50°
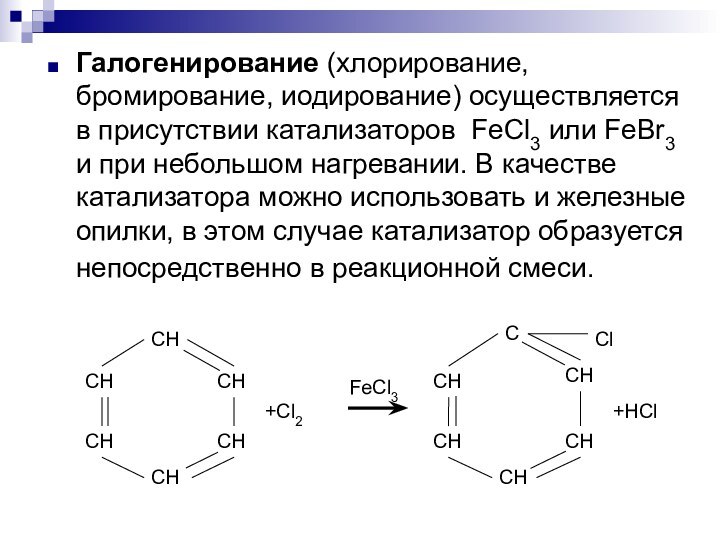
образуется тяжелая желтоватая жидкость с запахом горького миндаля – нитробензол:Слайд 4 Галогенирование (хлорирование, бромирование, иодирование) осуществляется в присутствии катализаторов
FeCl3 или FeBr3 и при небольшом нагревании. В качестве
катализатора можно использовать и железные опилки, в этом случае катализатор образуется непосредственно в реакционной смеси.Слайд 5 Сульфирование. При взаимодействии с серной кислотой бензол образует
бензолсульфоновую кислоту.
Слайд 6 Алкилирование – замещение атома водорода в бензольном кольце
на углеводородный радикал – можно осуществить при помощи галогеналканов
или алкенов в присутствии безводного хлорида алюминия. Эти реакции были открыты в 1887 году и названы по имени первооткрывателей реакциями Фриделя-Крафта:Слайд 7 Реакции присоединения протекают с большим трудом. На платиновых
катализаторах, под давлением и температуре 150° бензол присоединяет три
молекулы водорода с образованием циклогексана. При освещении УФ-светом бензол присоединяет три молекулы хлора с образованием гексахлорциклогексана.Слайд 8 К действию окислителей бензол довольно устойчив. Он не
поддается окислительному влиянию перманганата калия. Только кислород воздух при
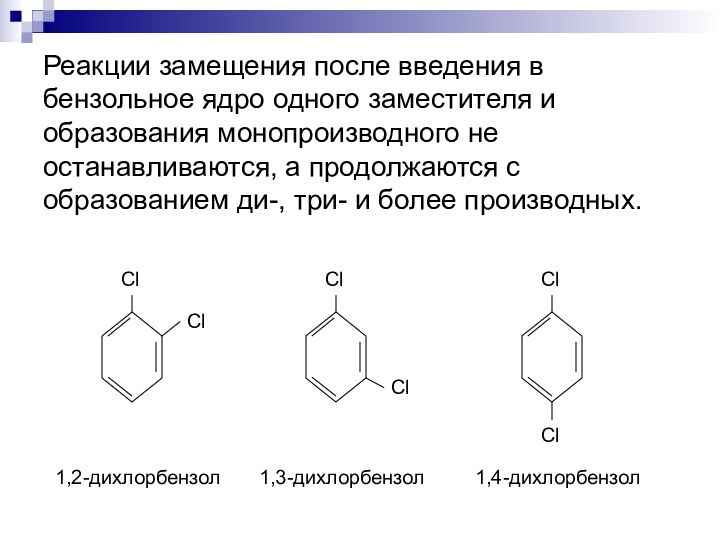
высокой температуре и в присутствии V2O5 окисляет бензол с разрывом кольца. Образуется двухосновная карбоновая кислота, известная как малеиновая, углекислый газ и вода:Слайд 10 Реакции замещения после введения в бензольное ядро одного
заместителя и образования монопроизводного не останавливаются, а продолжаются с
образованием ди-, три- и более производных.1,2-дихлорбензол
1,3-дихлорбензол
1,4-дихлорбензол
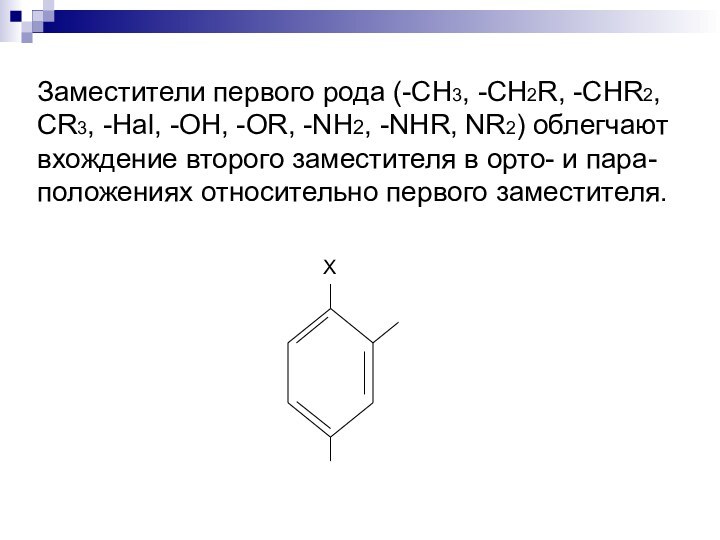
Слайд 11 Заместители первого рода (-CH3, -CH2R, -CHR2, CR3, -Hal,
-OH, -OR, -NH2, -NHR, NR2) облегчают вхождение второго заместителя
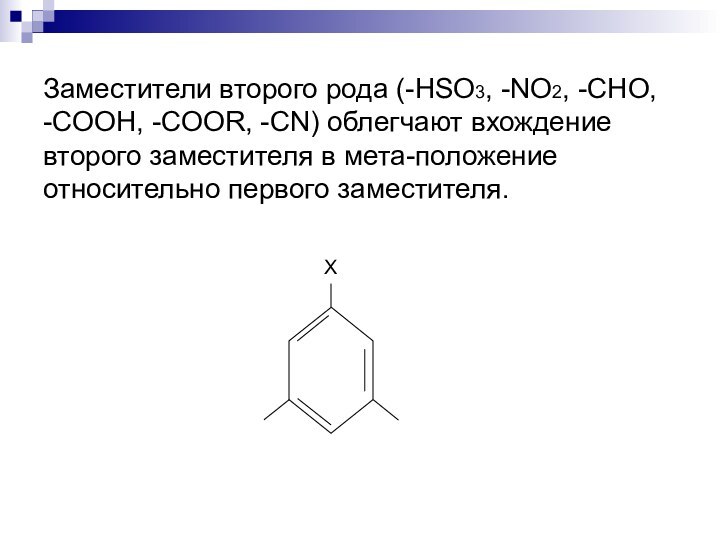
в орто- и пара-положениях относительно первого заместителя.Слайд 12 Заместители второго рода (-HSO3, -NO2, -CHO, -COOH, -COOR,
-CN) облегчают вхождение второго заместителя в мета-положение относительно первого
заместителя.Слайд 13 Сила заместителей первого рода –OH > –NH2 > –NHR
> –NR2 > > –OR > –CR3 > –CHR2 >
–CH2R > > –CH3 > –Hal Сила заместителей второго рода –CN > –COOH > –COOR > –CHO > –NO2 >–HSO3
Слайд 14
ЗАКРЕПЛЕНИЕ ПРОЙДЕННОГО МАТЕРИАЛА:
1. Запишите реакции нитрования и сульфирования
бензола по первой и второй стадии. Продукты реакции назовите.
2.
Запишите реакции хлорирования и алкилирования бензола по первой и второй стадии. Продукты реакции назовите.3. Запишите реакции хлорирования 1,3-диметилбензола, 1,2-диметилбензола, 1-метил-2-нитробензола, 1-метил-3-нитробензола, 1-метил-2-аминобензол Труднее или легче будут протекать эти реакции по сравнению с реакциями хлорирования?
Слайд 15
РЕШЕНИЕ РАСЧЕТНЫХ ЗАДАЧ:
Для сжигания ароматического углеводорода массой 21,2г
потребовалось 47,14л кислорода. Определите его молекулярную формулу, запишите и
назовите возможные изомеры, укажите тип гибридизации каждого атома углерода.Вычислите, какую массу бензола подвергли хлорированию на свету, если при этом было получено 11,35г продукта, что составляет 65% от теоретически возможного.
Смесь бензола с гексеном-1 массой 20г обесцвечивает 381г 4,2% раствора брома. Определить массовые доли компонентов в исходной смеси.