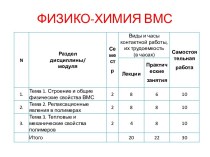
Слайд 2
Цель урока
Охарактеризовать серу в свете трёх форм существования
этого химического элемента: в форме атомов, простого вещества, а
следовательно, и аллотропию её а также в форме некоторых соединений серы.
Химические свойства серы как простого вещества рассмотреть в свете окислительно- восстановительных реакций.
Отрабатывать навыки работы с интерактивной доской.
Слайд 3
План урока
Повторение строения и свойств кислорода на основании
положения в ПСХЭ Д.И. Менделеева.
Строение свойства серы в сравнении
с кислородом и на основании положения в ПСХЭ Д.И. Менделеева.
Сера – простое вещество.
Физические свойства серы, аллотропные видоизменения серы.
Химические свойства серы.
Слайд 4
Вопросы для повторения
Расскажите о положении кислорода в ПСХЭ
Д.И. Менделеева. Сделайте вывод о свойствах атома кислорода.
Какое место
в ПСХЭ Д.И.Менделеева занимает сера?
Слайд 5
Строение И СВОЙСТВА атома кислорода на основании положения
в ПСХЭ Д.И.Менделеева
Кислород находится во 2-ом периоде,6 группы, главной
подгруппы.
+8О)2)6 2е,6е
Кислород всегда является окислителем, т.к. имеет самый маленький радиус, (исключение фтор) все орбитали заняты, нет дополнительной d орбитали.
Слайд 6
Строение И СВОЙСТВА атома СЕРЫ на основании положения
в ПСХЭ Д.И.Менделеева
(использование интерактивной доски)
Сера находится в 3-ем
периоде, 6 группы, главной подгруппы.
+16 S)2)8)6.
Сера является окислителем и восстановителем, имеет дополнительную d орбиталь.
В возбуждённом состоянии степени окисления. ,+4,+6.
Сера проявляет степени окисления:–2, 0,+2,+4,+6.
Слайд 7
Сера,как простое вещество (использование интерактивной доски. электронного учебника)
Сера
образует молекулы с чётным числом атомов. S2, S4, S6,S8
При обычных условиях устойчивая молекула S8, имеющая структуру короны. Из таких молекул построены две аллотропные кристаллические модификации серы: РОМБИЧЕСКАЯ И МООКЛИННАЯ. Ромбическая лимонно-жёлтая кристаллическая сера . При температуре 95*С ромбическая переходит в моноклинную при температуре 119*С она плавится, около 160*С кольца молекул S8 разрываются образуя бесконечные спирали. Моноклинная переходит в тёмно-коричневую смолообразную пластическую серу.
Слайд 8
Химические свойства серы (использование интерактивной доски, электронного учебника)
Взаимодействие
с металлами. При обычных условиях сера вступает в реакцию
с щелочными и щёлочноземельными металлами, медью, ртутью, серебром. .Реакция серы с ртутью используется для сбора ртути. Такой процесс называют демеркуризацией.
При нагревании сера реагирует и с другими металлами (Zn, Al, Fe ) и только золото не взаимодействует с ней ни при каких условиях.
Электронный учебник «Неорганическая химия». Смотрим демонстрацию «Взаимодействие серы с металлами».
Взаимодействие с неметаллами (Н2,С,О2).
Слайд 9
Взаимодействие с металлами
Взаимодействие с ртутью
Hg0 + S0
= Hg+2 S-2
Hg0 - 2e
Hg+2 1 восстановитель
окисления
S0 + 2e S -2 1 окислитель
восстановления
Взаимодействие с натрием
2Na0 + S0 = Na +1 S-2
Na0 - e Na+ 2 восстановитель
окисления
S0 + 2e S+2 1 окислитель
Восстановления
Слайд 10
Взаимодействие серы с водородом
2). Взаимодействие с водородом.
S +
H02 H+2S -2.
S0 +2e
S-2 1 ок-тель.
Восстановления.
H02 - 2e 2H+ 1 вос-тель.
Окисления.
Вывод: с металлами, с водородом сера проявляет окислительные свойства.
Слайд 11
3.Взаимодействие с углеродом
3) Взаимодействие с углеродом.
S0 + C0 = C+4
S-22.
S0 +2e S-2 2 ок-тель.
Восстановления.
C0 - 4е C+4 1 вос-тель.
Окисления.
Вывод: с менее электроотрицательными неметаллами, сера проявляет окислительные свойства.
Слайд 12
4.Взаимодействие с кислородом
4). Взаимодействие с кислородом.
S0 +
О02 = S+4 О-22.
S0 -
4e S+4 вос-тель.
Окисления.
О02 + 4е 2О-2 ок-тель.
Восстановления.
Вывод: по отношению к сильным окислителям сера проявляет восстановительные свойства.