Слайд 2
Цели урока:
Познакомить учащихся с основными предпосылками создания теории
строения органических соединений А. М. Бутлерова.
Рассмотреть основные положения.
Привести современную формулировку основного положения теории строения.
Раскрыть значение теории А. М. Бутлерова для органической химии.
Слайд 3
Задачи урока:
Образовательные:
изучить предпосылки создания теории химического строения,
ее основные положения, зависимость свойств веществ от строения молекулы,
значение теории строения для развития науки и жизнедеятельности человека;
углубить основные химические понятия: вещество, химическая реакция.
Развивающие:
развивать у учащихся умение сравнивать, анализировать и применять информацию из других областей знаний, развивать коммуникативные способности, умение предъявлять результаты групповой деятельности.
Воспитательные:
способствовать воспитанию у учащихся активной жизненной позиции.
Слайд 4
«Органическая химия может сейчас кого угодно свести с
ума. Она представляется мне дремучим лесом, полным удивительных вещей,
безграничной чащей, из которой нельзя выбраться, куда не осмеливаешься проникнуть»
(из письма Ф.Велера к Й.Берцелиусу 1835г.)
Слайд 5
Теория радикалов
(30 гг. XIX в Й.Берцелиус, Ю.Либих, Ж.Дюма)
В
состав органических веществ входят радикалы;
Радикалы всегда постоянны, не подвергаются
изменениям, переходят из одной молекулы в другую;
Радикалы могут существовать в свободном виде.
Понятие «радикал» прочно вошло в химию
Слайд 6
Теория типов
(40-50 гг. XIX в. Ш.Жерар, А.Кекуле и
др.)
Все органические вещества – производные простейших неорганических – типа
водорода, воды, аммиака и др.
Формулы выражают не внутреннее строение молекулы, а способы образования, свойства определяют все атомы молекулы;
Невозможно познать строение вещества, у каждого вещества столько формул, сколько его превращений существует.
Теория позволила классифицировать орг. Вещества, предсказать и открыть некоторые, особое внимание – химическим превращениям, но не могла прогнозировать, указывать пути синтеза новых веществ.
Слайд 7
К первой половине XIX века в органической химии
был накоплен громадный фактический материал, дальнейшее изучение которого тормозилось
отсутствием какой-либо систематизирующей основы. Начиная с 20-х годов XIX века стали появляться сменяющие друг друга теории, претендующие на обобщенное описание строения органических соединений. Одной из них была теория типов, разработанная в 40-50-х годах французским ученым Ш. Жераром. Согласно этой теории, все органические соединения рассматривались как производные простейших неорганических веществ, принятых за типы.
Слайд 8
Основные «противоречия»
органической химии
Многообразие веществ
– образовано небольшим числом элементов;
Кажущееся несоответствие валентности в органических веществах – С3Н8;
Различные физические и химические свойства соединений, имеющих одинаковую молекулярную формулу (С6Н12О6 – глюкоза, фруктоза; С4Н10О – бутиловый спирт, диэтиловый эфир)
Слайд 9
Предпосылки возникновения теории
Развитие и утверждение атомистических представлений (съезд
в Карслруэ, 1860г.);
Установление понятий валентности
(Э. Франкленд, 1853г.);
Понятие четырехвалентности углерода (А. Кекуле, 1858г.);
Идеи о соединении атомов углерода в цепи (А. Кекуле, А. Купер, 1857г.)
Целостной теории, подтвержденной экспериментом, не существовало.
Слайд 10
Незадолго до появления теории строения А. М. Бутлерова
немецким химиком Ф.А. Кекуле (1857) была разработана применительно к
органическим соединениям теория валентности, установившая такие факты, как четырехвалентность атома углерода и его способность образовывать углеродные цепи за счет соединения с атомами углерода.
Слайд 11
Теоретические разработки добутлеровского периода внесли определенный вклад в
познание строения органических соединений. Но ни одна из ранних
теорий не была всеобщей. И лишь А.М. Бутлерову удалось создать такую логически завершенную теорию строения, которая и по сей день служит научной основой органической химии. Теория строения А.М. Бутлерова базируется на материалистическом подходе к реальной молекуле и исходит из возможности познания ее строения экспериментальным путем. А.М. Бутлеров при установлении строения веществ придавал основополагающее значение химическим реакциям. Теория строения А.М. Бутлерова не только объясняла уже известные факты, ее научное значение заключалось в прогнозировании существования новых органических соединений.
Слайд 12
Бутлеров Александр Михайлович
(1828-1886)
Русский химик, академик Петербургской
АН (с 1874 г.). Окончил Казанский университет (1849 г.).
Работал там же (с 1857 г. — профессор, в 1860 и 1863 гг. — ректор). Создатель теории химического строения органических соединений, лежащей в основе современной химии. Обосновал идею о взаимном влиянии атомов в молекуле. Предсказал и объяснил изомерию многих органических соединений. Написал «Введение к полному изучению органической химии» (1864 г.) — первое в истории науки руководство, основанное на теории химического строения. Председатель Отделения химии Русского физико-химического общества (1878—1882).
Слайд 13
Личностные качества А. М. Бутлерова
А. М. Бутлерова отличали энциклопедичность химических знаний, умение анализировать
и обобщать факты, прогнозировать. Он предсказал существование изомера бутана, а затем получил его, равно как изомер бутилена — изобутилен.
А. М. Бутлеров создал первую в России школу химиков-органиков, из которой вышли блестящие ученые: В. В. Марковников, Д. П. Коновалов, А. Е. Фаворский и др.
Недаром Д. И. Менделеев писал: «А. М. Бутлеров — один из величайших русских ученых, он русский и по ученому образованию, и по оригинальности трудов».
Слайд 14
Теория строения органических соединений
Теория химического строения
органических соединений, выдвинутая А. М. Бутлеровым во второй половине
прошлого века (1861 г.), была подтверждена работами многих ученых, в том числе учениками Бутлерова и им самим.
Оказалось возможным на ее основе объяснить многие явления, до той поры не имевшие толкования: изомерию, гомологию, проявление атомами углерода четырехвалентности в органических веществах.
Теория выполнила и свою прогностическую функцию: на ее основе ученые предсказывали существование неизвестных еще соединений, описывали свойства и открывали их.
Слайд 15
Основные положения теории строения органических веществ
(А.М. Бутлеров
1861 – 1864 гг.)
1. Атомы в молекулах веществ соединены
согласно их валентности. Углерод в органических соединениях всегда четырехвалентен, а его атомы способны соединяться друг с другом, образуя различные цепи. Порядок соединения атомов в молекулах может быть отображен при помощи структурных формул.
Валентность
характеризует способность атомов химических элементов к
образованию химических связей, она определяет число химических связей, которыми данный атом соединен с другими атомами в молекуле.
Н2 ; Н Н
H
NH3; N H
H
Н2О; Н О Н
Слайд 17
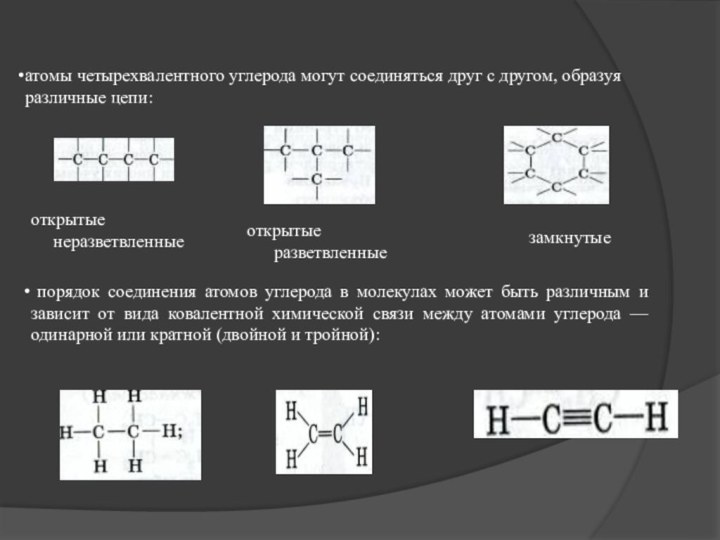
атомы четырехвалентного углерода могут соединяться друг с другом,
образуя различные цепи:
открытые
неразветвленные
замкнутые
порядок соединения атомов углерода в молекулах может быть различным и зависит от вида ковалентной химической связи между атомами углерода — одинарной или кратной (двойной и тройной):
Слайд 18
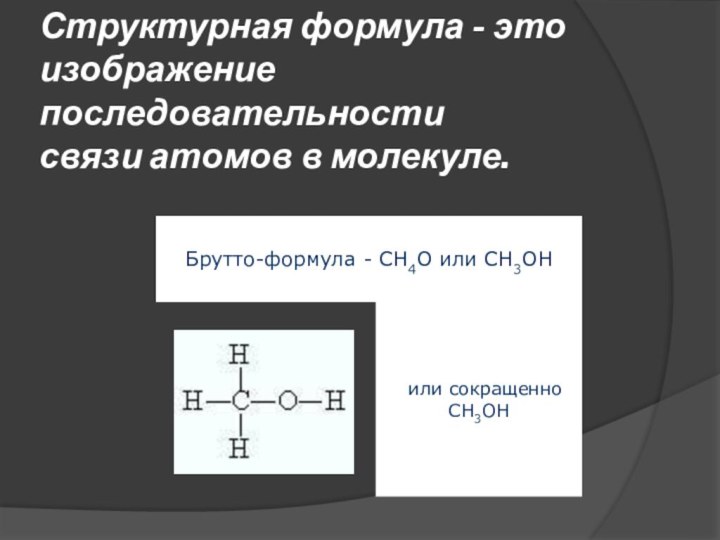
Структурная формула - это изображение последовательности
связи атомов в
молекуле.
Слайд 19
2. Свойства веществ определяются не только их качественным
и количественным составом, но и порядком соединения атомов в
молекуле, т.е. химическим строением вещества. Различное строение при одном и том же составе и относительной молекулярной массе вещества обуславливает явление изомерии.
Слайд 20
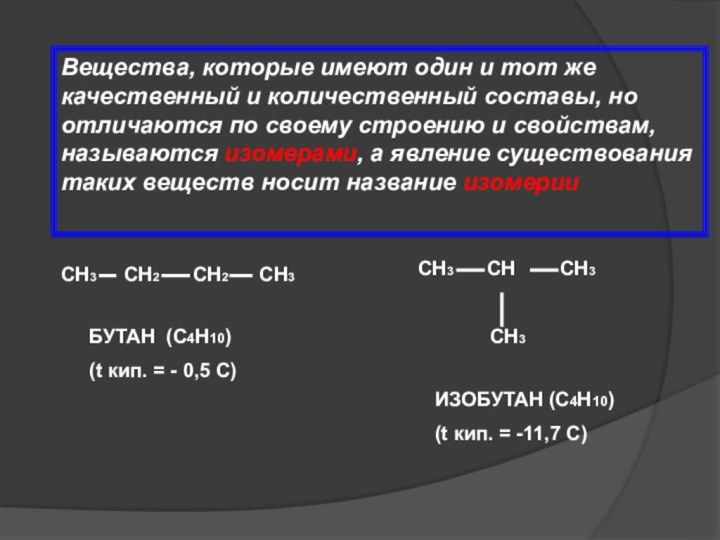
Вещества, которые имеют один и тот же качественный
и количественный составы, но отличаются по своему строению и
свойствам, называются изомерами, а явление существования таких веществ носит название изомерии
СН3 СН2 СН2 СН3
СН3 СН СН3
СН3
БУТАН (С4Н10)
(t кип. = - 0,5 С)
ИЗОБУТАН (С4Н10)
(t кип. = -11,7 С)
Слайд 22
Структурными называют изомеры, отвечающие различным структурным формулам органических
соединений (с разным порядком соединения атомов).
Пространственные
изомеры имеют одинаковые заместители у каждого атома углерода и отличаются лишь их взаимным расположением в пространстве.
Слайд 23
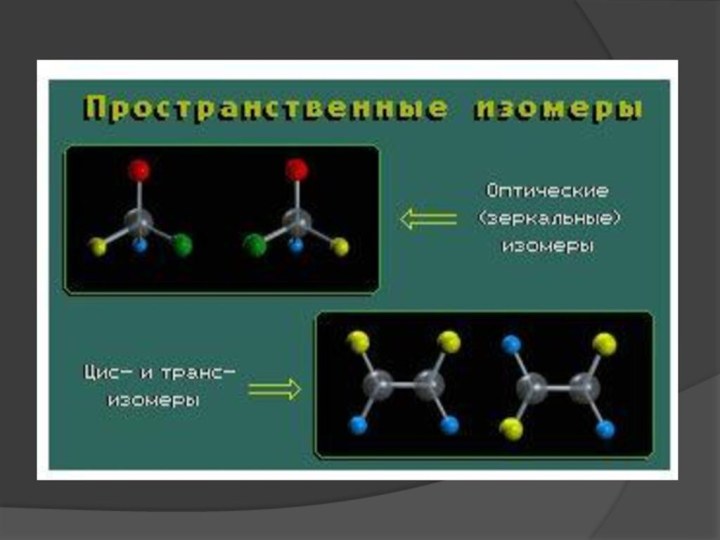
Пространственные изомеры (стереоизомеры). Стереоизомеры можно разделить на два
типа: геометрические изомеры и оптические изомеры.
Геометрическая изомерия характерна для
соединений, содержащих двойную связь или цикл. В таких молекулах часто возможно провести условную плоскость таким образом, что заместители у различных атомов углерода могут оказаться по одну сторону (цис-) или по разные стороны (транс-) от этой плоскости. Если изменение ориентации этих заместителей относительно плоскости возможно только за счет разрыва одной из химических связей, то говорят о наличии геометрических изомеров. Геометрические изомеры отличаются своими физическими и химическими свойствами.
Слайд 24
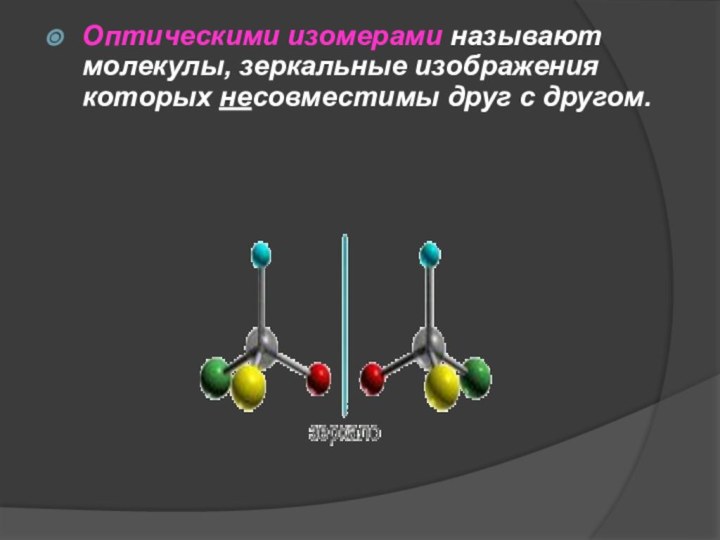
Оптическими изомерами называют молекулы, зеркальные изображения которых несовместимы
друг с другом.
Слайд 27
Открыт новый способ получения оптических изомеров органических молекул
Слайд 28
Американские ученые научились получать оптические изомеры соединений на
основе альдегидов, осуществив наконец важную реакцию, над которой химики
работали многие годы. В эксперименте они объединили два катализатора, работающие по разным принципам. В результате совместного действия этих катализаторов образуются две активных органических молекулы, которые объединяются в требуемое вещество. На примере этой реакции показана возможность синтеза целого класса биологически важных органических соединений.
Слайд 29
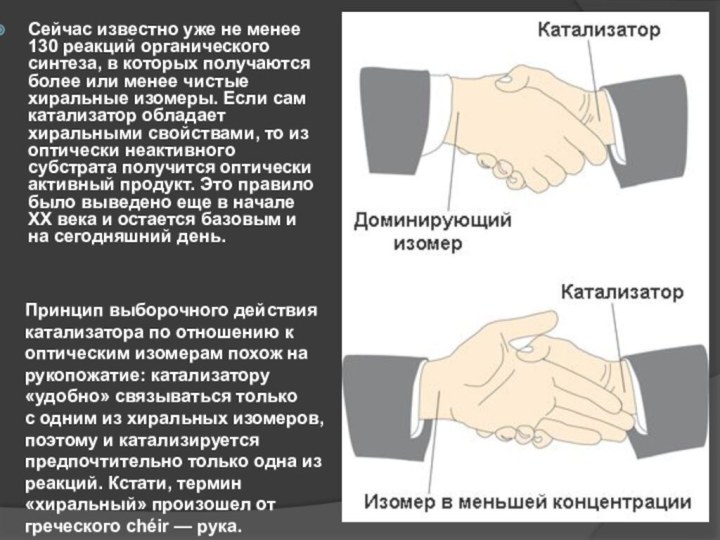
Сейчас известно уже не менее 130 реакций органического синтеза,
в которых получаются более или менее чистые хиральные изомеры. Если
сам катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получится оптически активный продукт. Это правило было выведено еще в начале XX века и остается базовым и на сегодняшний день.
Принцип выборочного действия катализатора по отношению к оптическим изомерам похож на рукопожатие: катализатору «удобно» связываться только с одним из хиральных изомеров, поэтому и катализируется предпочтительно только одна из реакций. Кстати, термин «хиральный» произошел от греческого chéir — рука.
Слайд 31
Зеркальные изомеры (+)-a-аминопропионовой кислоты и
(-)-a-аминопропионовой кислоты.
Слайд 32
Итак, изомерия –
одно из наиболее своеобразных
проявлений
специфики и особенности органической химии.
Слайд 33
3. Свойства органических соединений зависят от взаимного влияния
атомов и групп атомов в молекуле друг на друга.
Наибольшее влияние оказывают атомы, непосредственно связанные друг с другом. Влияние атомов или групп атомов, не связанных непосредственно, ослабевает по мере их удаления друг от друга.
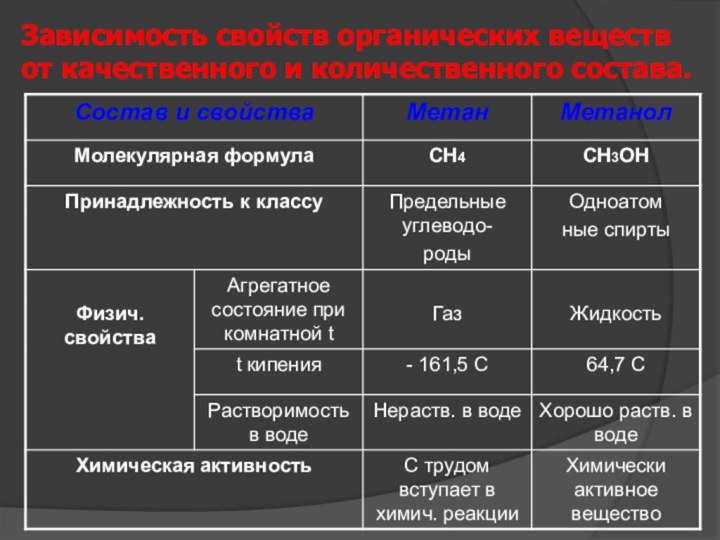
Слайд 34
Зависимость свойств органических веществ от качественного и количественного
состава.
Слайд 35
4. Зная строение вещества, можно предположить его свойства.
И наоборот, зная свойства вещества, можно предположить его строение.
СН3 СН2 ОН этиловый спирт
С2Н6О
СН3 О СН3 диметиловый эфир
Если известно, что вещество, имеющее молекулярную формулу С2Н6О, вступает в химические реакции, характерные для спиртов (П: выделяет водород в реакции с металлическим натрием), то можно сделать вывод, что мы говорим об этиловом спирте С2Н5ОН.
Слайд 36
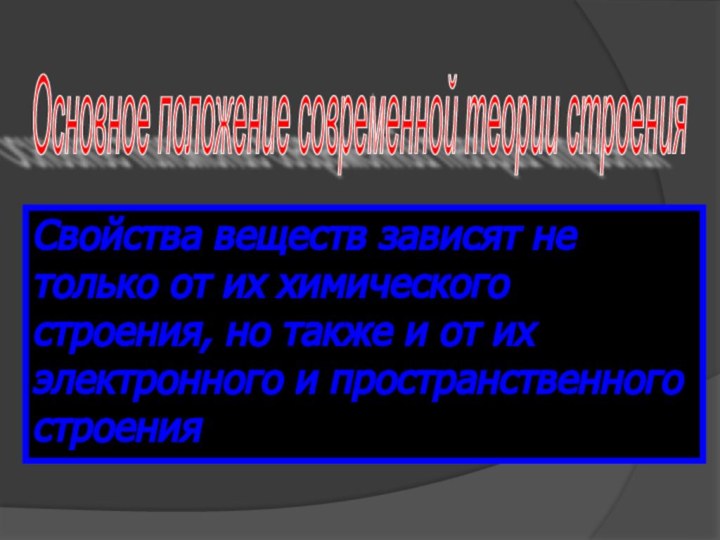
Основное положение современной теории строения
Свойства веществ зависят
не только от их химического строения, но также и
от их электронного и пространственного строения
Слайд 38
Франкленд (Frankland) Эдуард (1825-99), английский химик-органик, иностранный член-корреспондент
Петербургской АН (1876). Ввел термин «валентность» (1853).
Слайд 39
Берцелиус (Berzelius) Йенс Якоб (1779-1848), шведский химик и
минералог, иностранный почетный член Петербургской АН (1820). Открыл церий
(1803), селен (1817), торий (1828). Создал (1812-19) электрохимическую теорию химического сродства, на ее основе построил классификацию элементов, соединений и минералов. Определил (1807-18) атомные массы 45 элементов, ввел (1814) современные химические знаки элементов. Предложил термин «катализ».
Слайд 40
Кекуле (Kekule) Фридрих Август (1829-96), немецкий химик-органик, иностранный
член-корреспондент Петербургской АН (1887). Труды по теории строения органических
соединений. Показал, что углерод четырехвалентен (1857) и его атомы могут соединяться друг с другом в цепи (1858). Предложил (1865) циклическую формулу бензола.