- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химические свойства солей
Содержание
- 2. Определение солей Мех(КО)уКО - кислотный остатокNa2SO4
- 3. Классификация солейКислые СредниеОсновныеNa2SO3КHCO3 Mg(OH)ClСульфит натрияГидроксохлорид магнияГидрокарбонат калияН - гидроОН - гидроксоКислотный остаток
- 4. Химические свойства солейРастворимые солиСильные электролитыПолностью распадаются на ионыРастворы солей проводят ток
- 5. Электролиты растворимые Основания Соли Кислоты Реакции в растворах электролитов протекают между ионамиПризнак реакцииОсадокГазВода
- 6. BaCl2 + H2SO4 BaSO4 + 2HClСоли
- 7. С щелочамиВыпадает осадок CuCl2 + 2NaOH
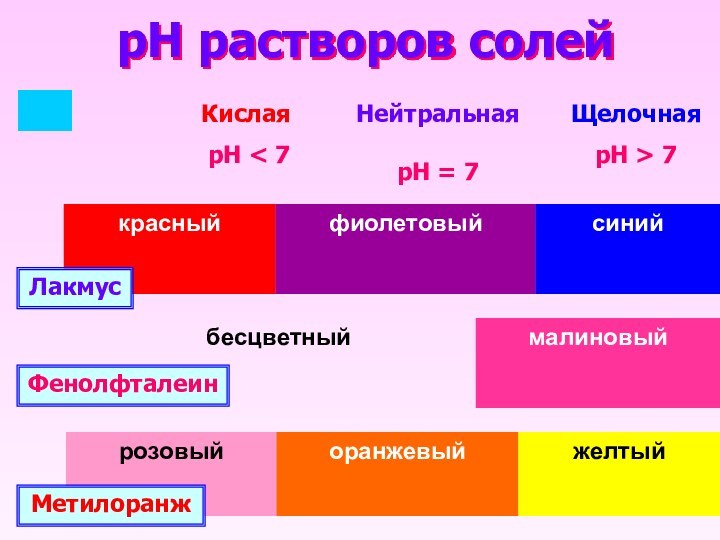
- 9. pH растворов солей ЛакмусФенолфталеинМетилоранжКислая рН < 7НейтральнаярН = 7ЩелочнаярН > 7
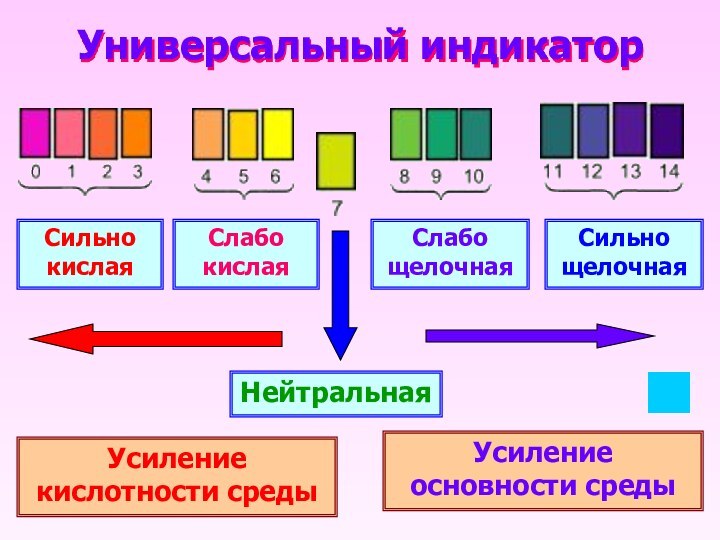
- 10. Универсальный индикатор Сильно кислаяСлабо кислаяСлабо щелочнаяСильно щелочнаяНейтральнаяУсиление кислотности средыУсиление основности среды
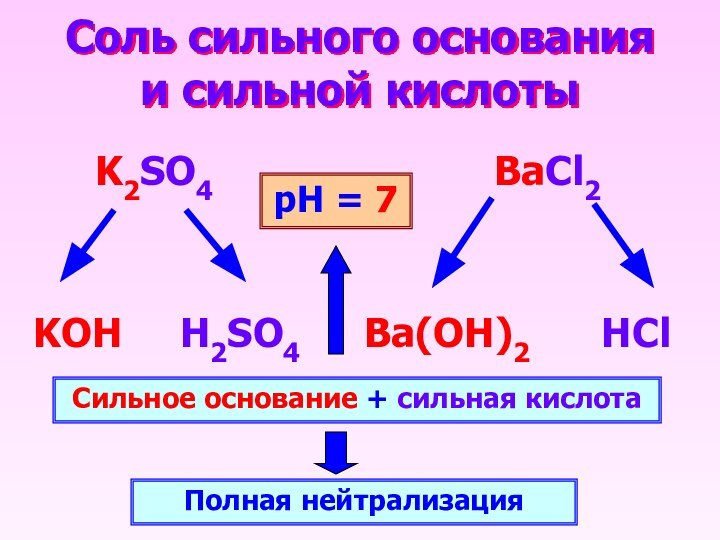
- 12. Соль сильного основания и сильной кислоты K2SO4
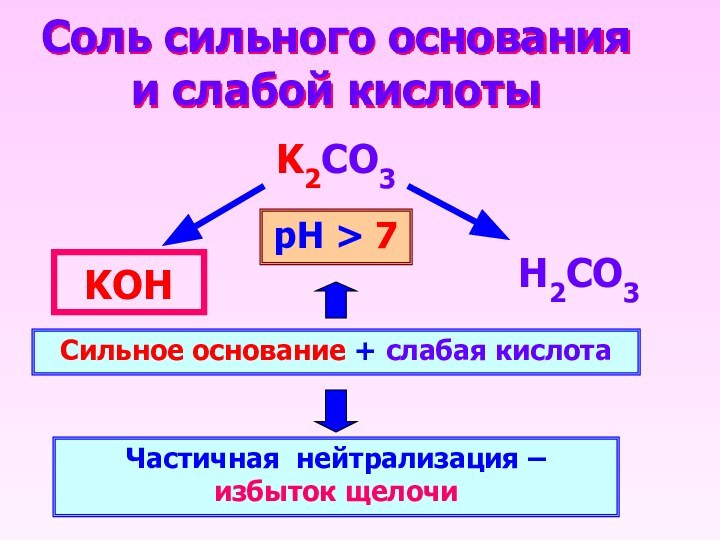
- 13. Соль сильного основания и слабой кислотыK2CO3Н2CO3KОНСильное основание + слабая кислотаЧастичная нейтрализация – избыток щелочирН > 7
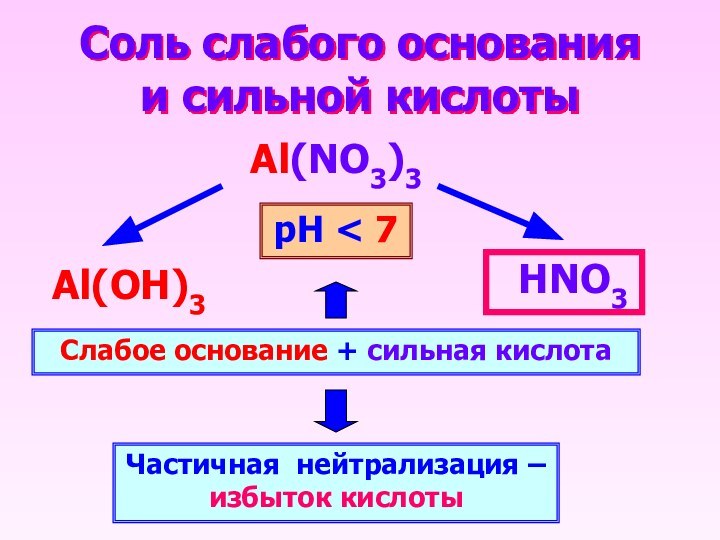
- 14. Соль слабого основания и сильной кислотыAl(NO3)3НNO3Al(OН)3Слабое основание + сильная кислотаЧастичная нейтрализация – избыток кислотырН < 7
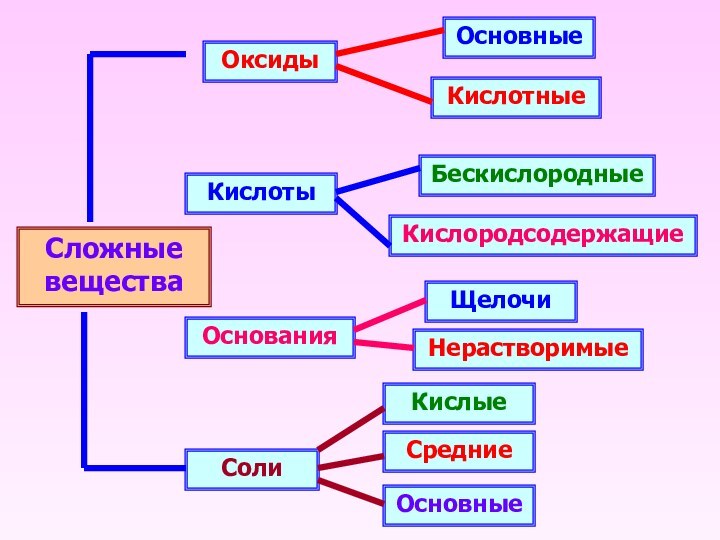
- 15. Сложные вещества Оксиды Кислоты ОснованияСоли Основные Кислотные Кислородсодержащие Бескислородные ЩелочиНерастворимые Основные Средние Кислые
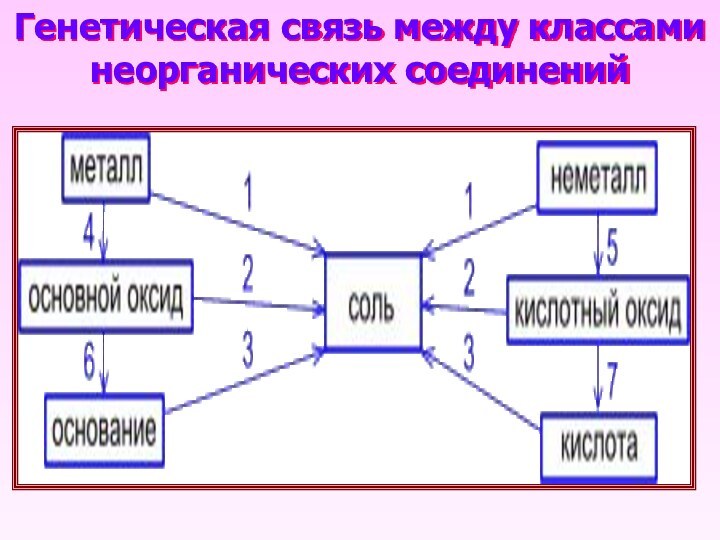
- 16. Генетическая связь между классами неорганических соединений
- 17. Примеры1. Металл + неметалл сольHg +
- 18. 2. Основание + кислота сольCu(OH)2 +
- 19. металл ® основной оксид4Li + O2
- 20. Скачать презентацию
- 21. Похожие презентации
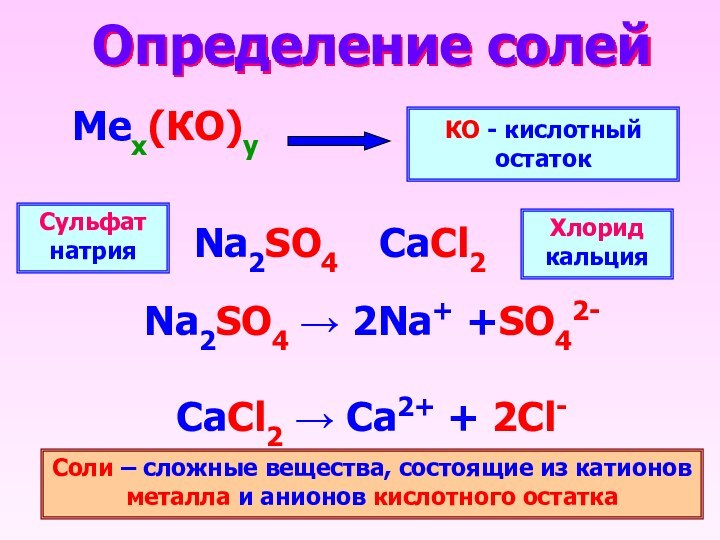
Определение солей Мех(КО)уКО - кислотный остатокNa2SO4 2Na+ +SO42-CaCl2 Ca2+ + 2Cl-Na2SO4CaCl2Сульфат натрияХлорид кальцияСоли – сложные вещества, состоящие из катионов металла и анионов кислотного остатка

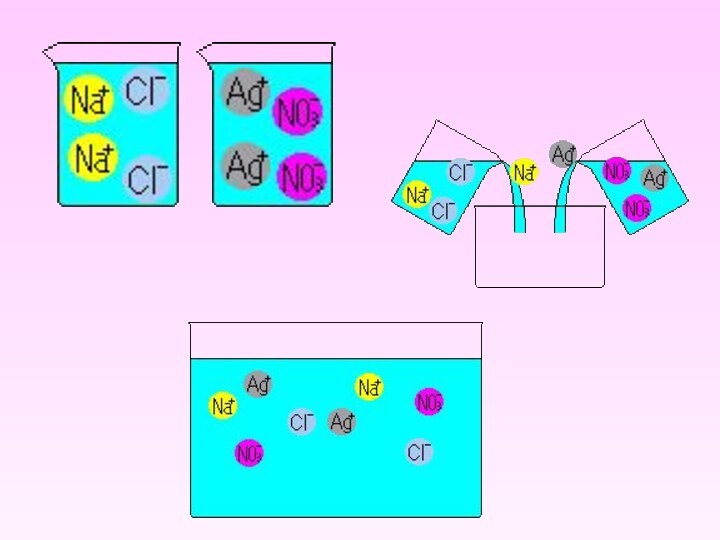


Слайд 2
Определение солей
Мех(КО)у
КО - кислотный остаток
Na2SO4 2Na+
+SO42-
вещества, состоящие из катионов металла и анионов кислотного остатка
Слайд 3
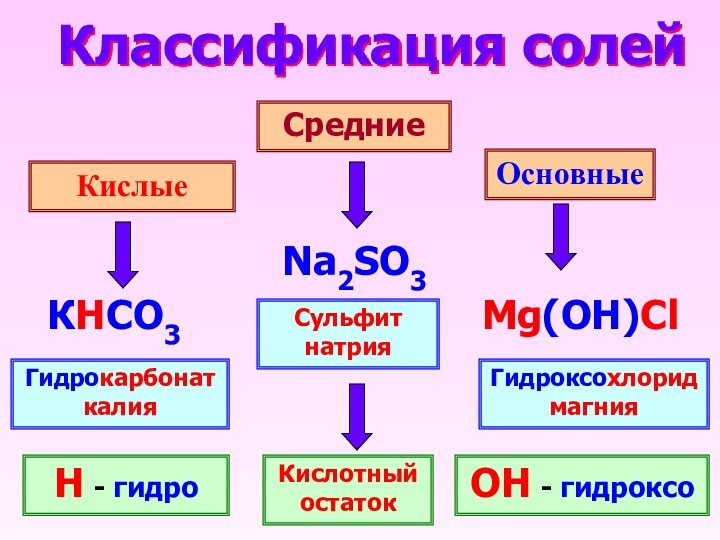
Классификация солей
Кислые
Средние
Основные
Na2SO3
КHCO3
Mg(OH)Cl
Сульфит натрия
Гидроксохлорид магния
Гидрокарбонат калия
Н -
гидро
ОН - гидроксо
Кислотный остаток
Слайд 4
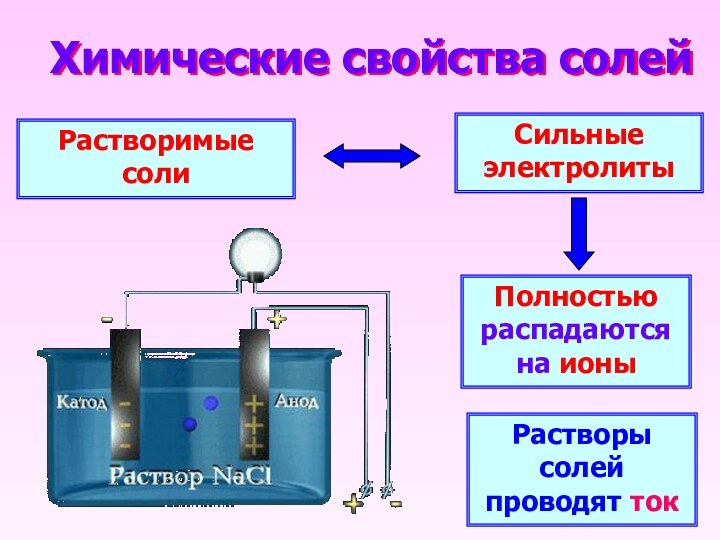
Химические свойства солей
Растворимые соли
Сильные электролиты
Полностью распадаются на ионы
Растворы
солей проводят ток
Слайд 5
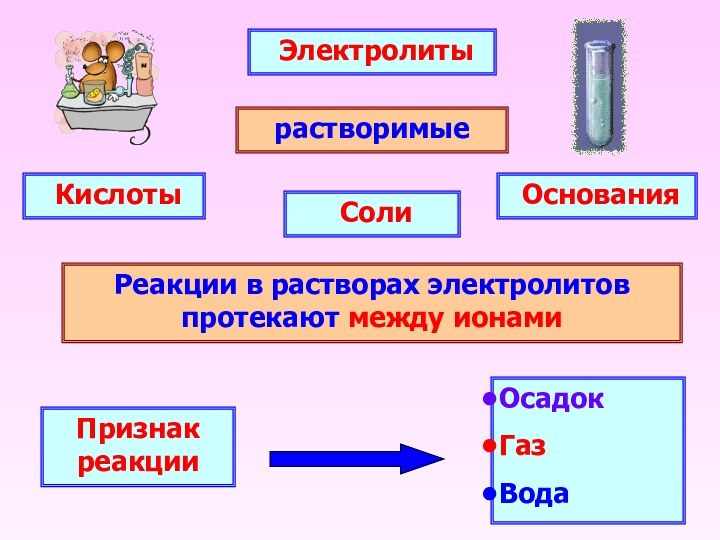
Электролиты
растворимые
Основания
Соли
Кислоты
Реакции
в растворах электролитов протекают между ионами
Признак реакции
Осадок
Газ
Вода
Слайд 6
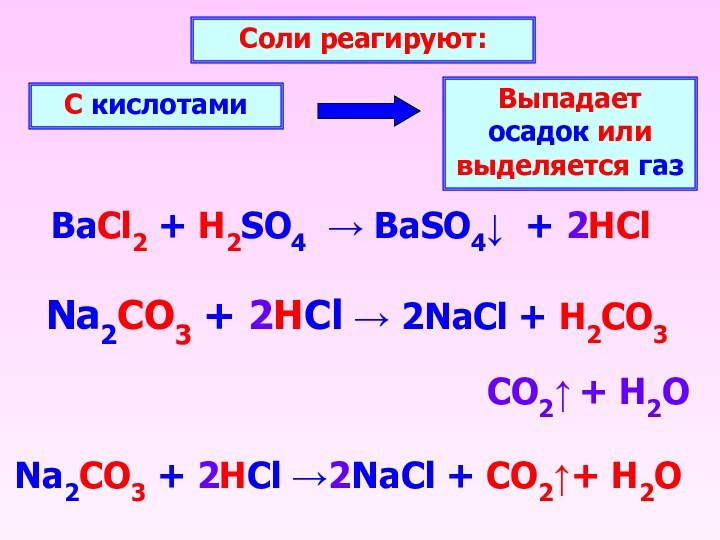
BaCl2 + H2SO4 BaSO4 + 2HCl
Соли реагируют:
С
кислотами
Выпадает осадок или выделяется газ
Na2CO3 + 2HCl 2NaCl
+ H2CO3CO2 + H2O
Na2CO3 + 2HCl 2NaCl + CO2+ H2O
Слайд 7
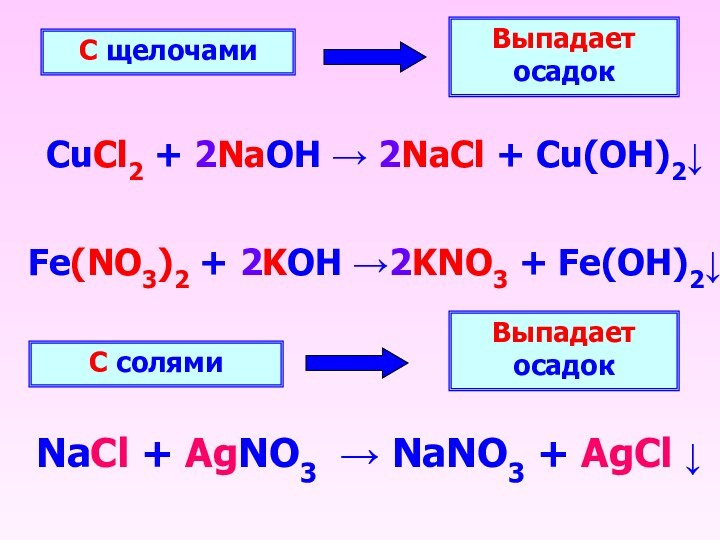
С щелочами
Выпадает осадок
CuCl2 + 2NaOH 2NaCl +
Cu(OH)2
С солями
Выпадает осадок
NaCl + AgNO3 NaNO3 + AgCl
Fe(NO3)2 + 2KOH 2KNO3 + Fe(OH)2
Слайд 10
Универсальный индикатор
Сильно кислая
Слабо кислая
Слабо щелочная
Сильно щелочная
Нейтральная
Усиление кислотности
среды
Усиление основности среды
Слайд 12
Соль сильного основания и сильной кислоты
K2SO4
BaCl2
KOH
H2SO4
HCl
Ba(OH)2
Сильное основание + сильная кислота
Полная нейтрализация
рН = 7
Слайд 13
Соль сильного основания и слабой кислоты
K2CO3
Н2CO3
KОН
Сильное основание +
слабая кислота
Частичная нейтрализация – избыток щелочи
рН > 7
Слайд 14
Соль слабого основания и сильной кислоты
Al(NO3)3
НNO3
Al(OН)3
Слабое основание +
сильная кислота
Частичная нейтрализация – избыток кислоты
рН < 7
Слайд 15
Сложные вещества
Оксиды
Кислоты
Основания
Соли
Основные
Кислотные
Кислородсодержащие
Бескислородные
Щелочи
Нерастворимые
Основные
Средние
Кислые
Слайд 17
Примеры
1. Металл + неметалл соль
Hg + S
HgS
2Al + 3I2 2AlI3
2. Основной оксид +
кислотный оксид сольLi2O + CO2 Li2CO3
CaO + SiO2 CaSiO3
Слайд 18
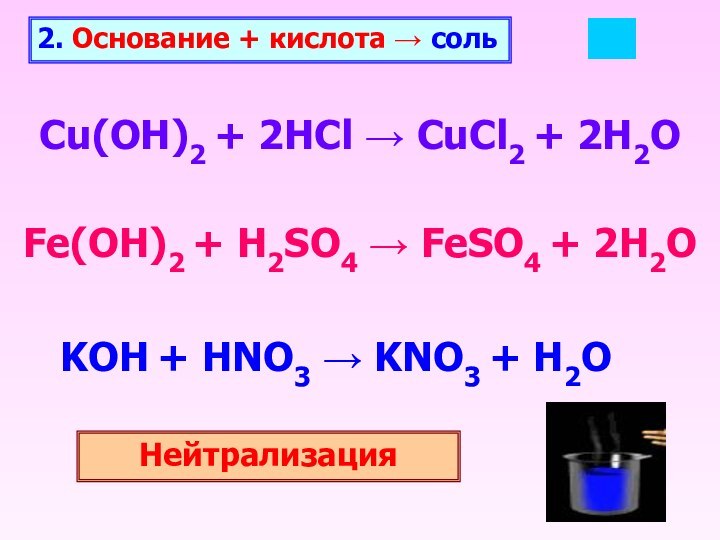
2. Основание + кислота соль
Cu(OH)2 + 2HCl
CuCl2 + 2H2O
Fe(OH)2 + H2SO4 FeSO4 +
2H2OKOH + HNO3 KNO3 + H2O
Нейтрализация
Слайд 19
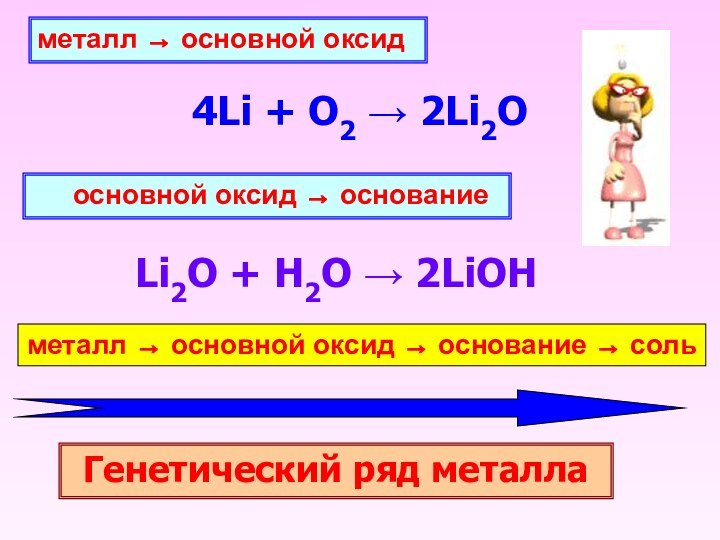
металл ® основной оксид
4Li + O2 2Li2O
основной оксид ® основание
Li2O + H2O 2LiOH
металл ®
основной оксид ® основание ® сольГенетический ряд металла