2·x = 0
2·x = 6
X = 3
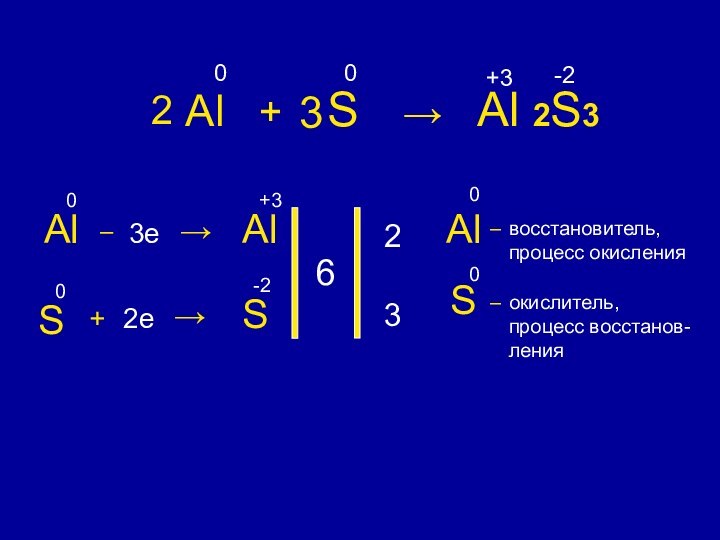
Сумма степеней окисления
химических элементов в соединении равна 0+ 3
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть


















+ 3
В этой химической реакции степени окисления
химических элементов в исходных веществах и
в продуктах реакции не изменяются
окислительно-восстановительным
реакциям.
у атома меди степень окисления уменьшилась
У атома углерода степень окисления увеличилась
Не окислительно - восстановительные
0
- 3
S – 2e → S
0
0
- 3