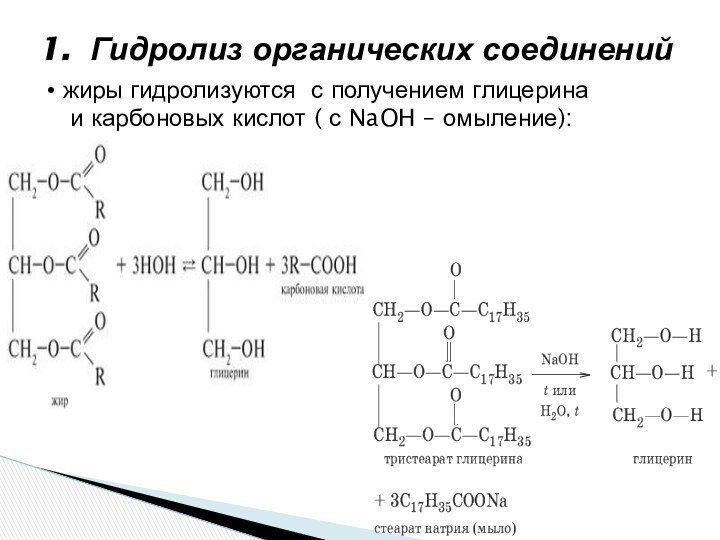
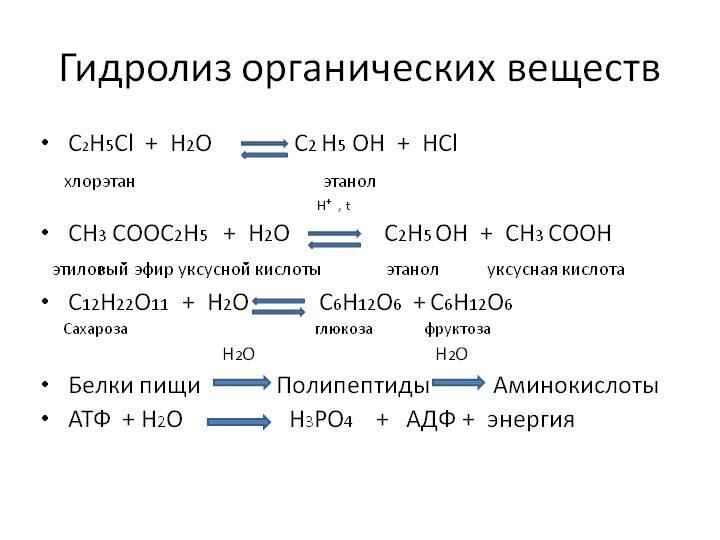
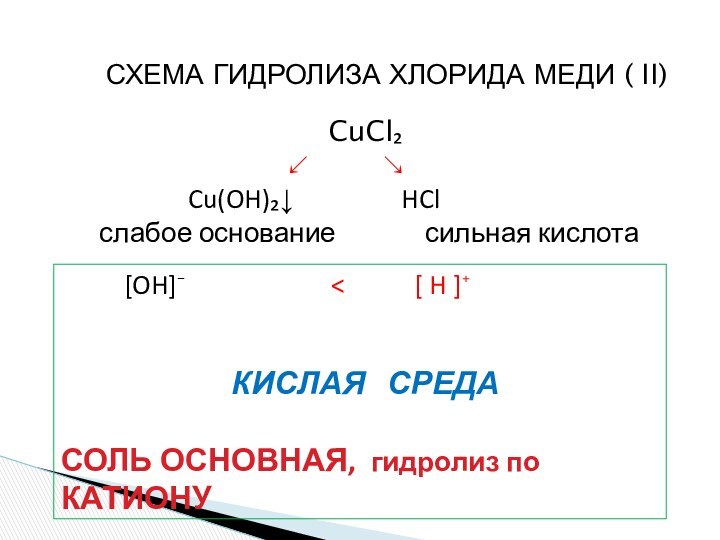
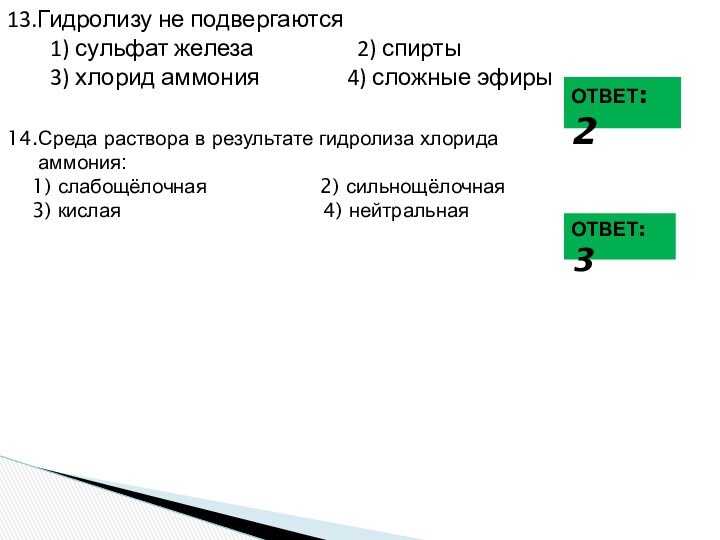
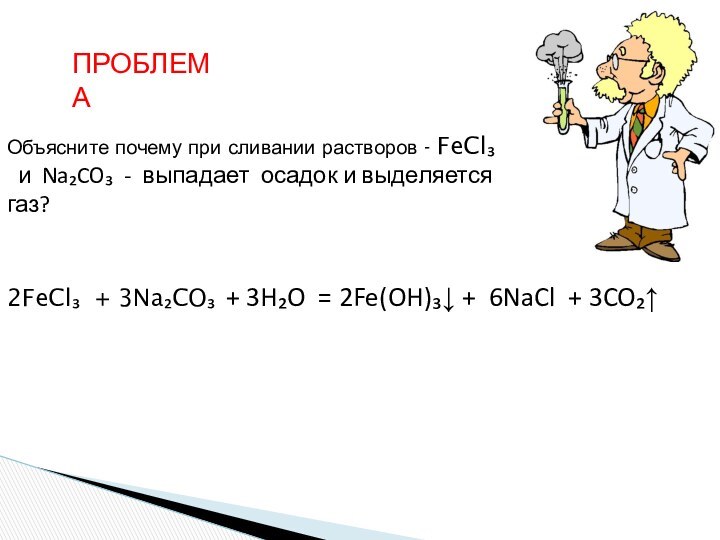
ионного обмена в растворах
(водных) растворимых солей-электролитов.
Движущей
силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей.
Г И Д Р О Л И З С О Л Е Й
1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону).
2. Гидролиз соли сильной кислоты и слабого основания (гидролиз
по катиону).
3. Гидролиз соли слабой кислоты и слабого основания
(необратимый)
Соль сильной кислоты и сильного основания не подвергается гидролизу