- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по теме: Амины, номенклатура, изомерия, химические свойства
Содержание
- 2. ХИМИЧЕСКИЕ СВОЙСТВА АМИНОВРЕАКЦИИ ГОРЕНИЯВЗАИМОДЕЙСТВИЕ С НЕОРГАНИЧЕСКИМИ КИСЛОТАМИВЗАИМОДЕЙСТВИЕ С ВОДОЙРЕАКЦИИ АЛКИЛИРОВАНИЯВЗАИМОДЕЙСТВИЕ С АЗОТИСТОЙ КИСЛОТОЙ
- 3. Р Е А К Ц И И
- 5. Основные свойства аминов- взаимодействие с кислотамиВывод: при
- 6. Взаимодействие аммиака с серной кислотой:NH3 + H2SO4
- 7. Основные свойства аминов- взаимодействие с кислотами CH3C2H5NH
- 9. Основные свойства аминов- взаимодействие с водойВывод: при
- 10. Взаимодействие с азотистой кислотой первичных аминовВывод: первичные
- 11. Взаимодействие с азотистой кислотой вторичных аминовВывод: вторичные
- 12. Взаимодействие с азотистой кислотой вторичных аминовВывод: вторичные
- 13. Реакция алкилирования первичных аминовВывод: в реакции алкилирования
- 14. Реакция алкилирования вторичных аминовВывод: в реакции алкилирования
- 15. Способы получения аминовВосстановление нитросоединений:CH3 – NO2 +
- 16. 2. Реакция алкилирования аминов: CH3NH2 + C2H5Cl
- 17. 3).Аминирование спиртовAl2O3 R – OH
- 18. 4). Лабораторный способ получения аминов Взаимодействием солей аммония
- 19. Сила оснований, согласно теории Льюйса определяется способностью присоединять протон водорода (Н ) +
- 20. Скачать презентацию
- 21. Похожие презентации




![Презентация по теме: Амины, номенклатура, изомерия, химические свойства Основные свойства аминов- взаимодействие с кислотами CH3C2H5NH + H2SO4 → [CH3C2H5NH2]HSO4МетилэтиламинГидросульфат метилэтиламмония](/img/tmb/6/590444/9cb5d2bf43093ac9d4b212ba78b6d3d2-720x.jpg)




![Презентация по теме: Амины, номенклатура, изомерия, химические свойства 2. Реакция алкилирования аминов: CH3NH2 + C2H5Cl → [CH3C2H5NH2]Cl → CH3C2H5NH +](/img/tmb/6/590444/1baea4305714fd0dd0f8c004fe54a708-720x.jpg)


Слайд 2
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОВ
РЕАКЦИИ ГОРЕНИЯ
ВЗАИМОДЕЙСТВИЕ С НЕОРГАНИЧЕСКИМИ КИСЛОТАМИ
ВЗАИМОДЕЙСТВИЕ С
ВОДОЙ
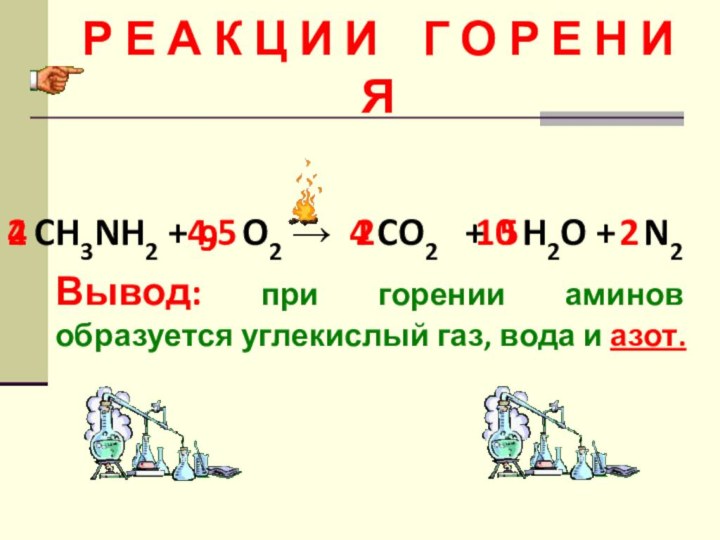
Слайд 3 Р Е А К Ц И И
Г О Р Е Н И Я
Вывод: при горении
аминов образуется углекислый газ, вода и азот. CH3NH2 + O2 → CO2 + H2O + N2
2
2
5
4,5
4
9
4
10
2
Слайд 5
Основные свойства аминов- взаимодействие с кислотами
Вывод: при взаимодействии
с кислотами амины проявляют основные свойства
NH3 +
HCl → NH4Cl CH3NH2 + HCl → [CH3NH3]Cl
аммиак
Хлорид аммония
метиламин
Хлорид метиламмония
(CH3)2NH + HNO3→ [(CH3)2NH2]NO3
диметиламин
Нитрат диметиламмония
Слайд 6
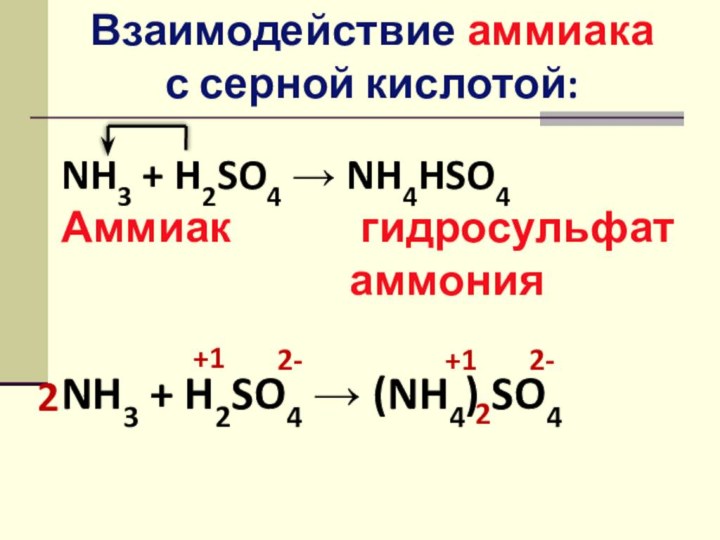
Взаимодействие аммиака с серной кислотой:
NH3 + H2SO4 →
NH4HSO4
Аммиак гидросульфат
аммония
NH3 + H2SO4 → (NH4) SO4
+1
2-
+1
2-
2
2
Слайд 7
Основные свойства аминов- взаимодействие с кислотами
CH3C2H5NH +
H2SO4 → [CH3C2H5NH2]HSO4
Метилэтиламин
Гидросульфат метилэтиламмония
CH3
CH3\ \
NH + H2SO4→ NH2 SO4
/ /
C2H5 C2H5
2
2
Слайд 9
Основные свойства аминов- взаимодействие с водой
Вывод: при взаимодействии
с водой амины проявляют основные свойства
NH3 +
HOH → NH4OH CH3NH2 + HOH → [CH3NH3]OH
аммиак
Гидроксид аммония
метиламин
Гидроксид метиламмония
(C2H5)2NH + HOH→ [(C2H5)2NH2]OH
диэтиламин
гидроксид диэтиламмония
Слайд 10
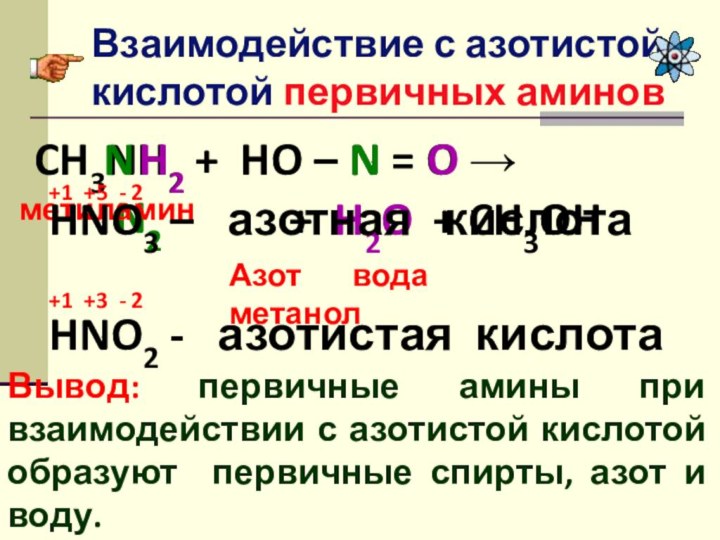
Взаимодействие с азотистой кислотой первичных аминов
Вывод: первичные амины
при взаимодействии с азотистой кислотой образуют первичные спирты, азот
и воду. CH3NH2 + HO – N = O →
N2
N
N
H2
O
+ H2O
+ CH3OH
метиламин
Азот вода метанол
HNO3 – азотная кислота
HNO2 - азотистая кислота
+1 +3 - 2
+1 +5 - 2
Слайд 11
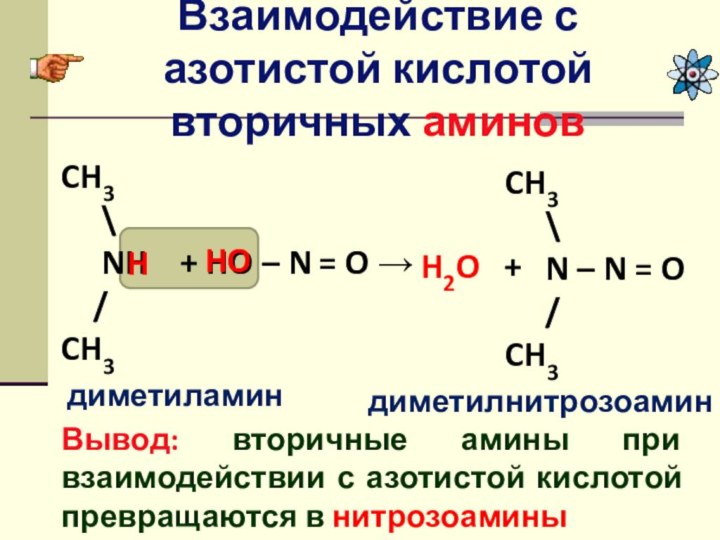
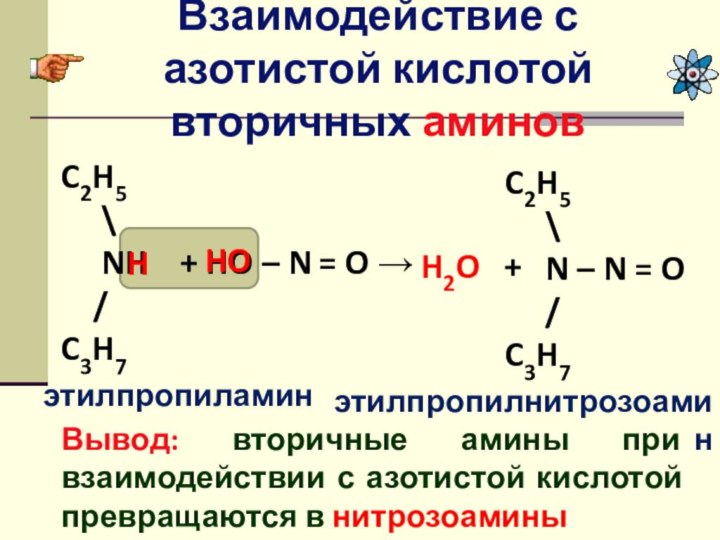
Взаимодействие с азотистой кислотой вторичных аминов
Вывод: вторичные амины
при взаимодействии с азотистой кислотой превращаются в нитрозоамины
CH3
\NH + HO – N = O →
/
CH3
H
HO
H2O +
CH3
\
N – N = O
/
CH3
диметиламин
диметилнитрозоамин
Слайд 12
Взаимодействие с азотистой кислотой вторичных аминов
Вывод: вторичные амины
при взаимодействии с азотистой кислотой превращаются в нитрозоамины
C2H5
\NH + HO – N = O →
/
C3H7
H
HO
H2O +
C2H5
\
N – N = O
/
C3H7
этилпропиламин
этилпропилнитрозоамин
Слайд 13
Реакция алкилирования первичных аминов
Вывод: в реакции алкилирования первичный
амин превращается во вторичный амин
CH3NH2 + CH3Cl → [(CH3)2NH2]Cl
метиламин
Хлорид
диметиламмония[(CH3)2NH2]Cl + NH3→
1 стадия:
2 стадия:
Хлорид диметиламмония
Диметиламин
NH4Cl +
(CH3)2NH
Слайд 14
Реакция алкилирования вторичных аминов
Вывод: в реакции алкилирования вторичный
амин превращается в третичный амин
(CH3)2NH + CH3Cl → [(CH3)3NH]Cl
диметиламин
Хлорид
триметиламмония[(CH3)3NH]Cl + NH3 →
1 стадия:
2 стадия:
Хлорид триметиламмония
Триметиламин
NH4Cl +
(CH3)3N
Слайд 15
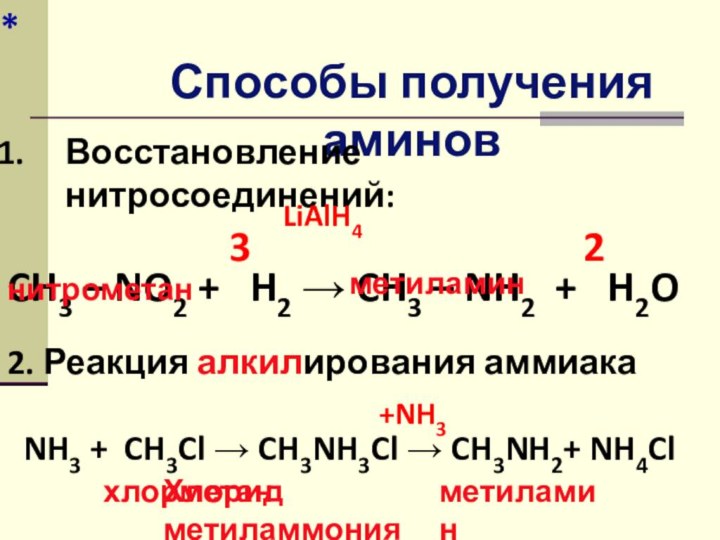
Способы получения аминов
Восстановление нитросоединений:
CH3 – NO2 +
H2 → CH3 – NH2 + H2O
2
3
нитрометан
метиламин
LiAlH4
2. Реакция
алкилирования аммиака NH3 + CH3Cl → CH3NH3Cl → CH3NH2+ NH4Cl
+NH3
хлорметан
Хлорид метиламмония
метиламин
*
Слайд 16
2. Реакция алкилирования аминов:
CH3NH2 + C2H5Cl →
[CH3C2H5NH2]Cl →
CH3C2H5NH + NH4Cl
+NH3
метиламин
хлорэтан
хлоридметилэтиламмония
метилэтиламин
Реакция Гофмана
Август Вильгельм Гофман
(1818–1892), немецкий
химик
Слайд 17
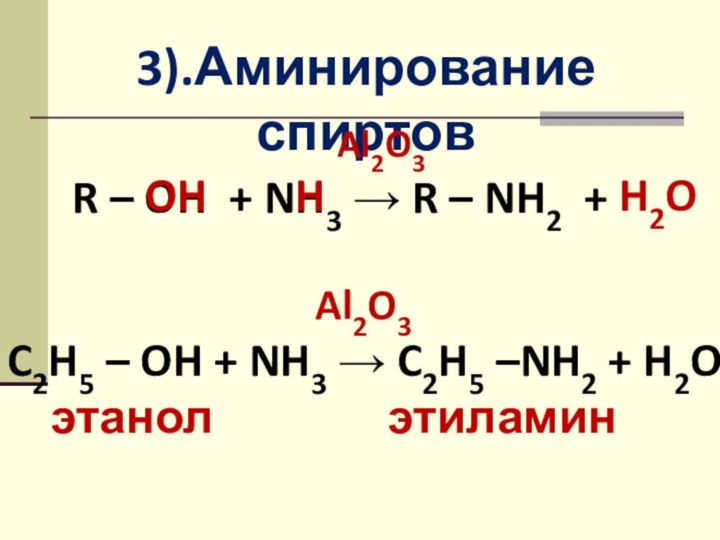
3).Аминирование спиртов
Al2O3
R – OH +
NH3 → R – NH2 +
Al2O3C2H5 – OH + NH3 → C2H5 –NH2 + H2O
этанол этиламин
OH
H
H2O
Слайд 18
4). Лабораторный способ получения аминов
Взаимодействием солей аммония со
щелочью:
[C2H5 NH3]Cl + NaOH →
C2H5NH2+ NaCl + H2O
t°
Хлорид
этиламмония
Этиламин





























