- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Положение металлов в таблице Д.И. Менделеева. Особенности строения атомов, свойства
Содержание
- 2. Цель урока: 1. на основе положения
- 3. МЕДЬИду на мелкую монету, В колоколах люблю
- 4. ЖЕЛЕЗОПахать и строить - все он может, если ему уголек в том поможет…
- 5. Металлы – это группа веществ с общими свойствами.
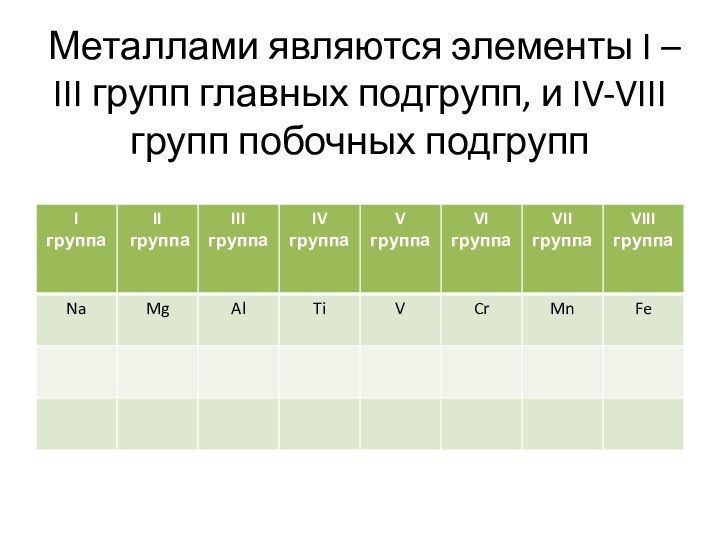
- 6. Металлами являются элементы I – III групп главных подгрупп, и IV-VIII групп побочных подгрупп
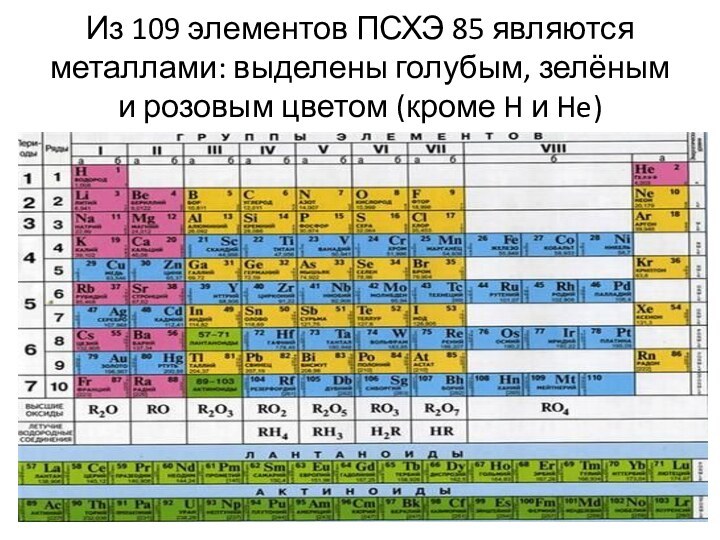
- 7. Из 109 элементов ПСХЭ 85 являются металлами:
- 8. Положение элемента в ПС отражает строение его атомов
- 9. Модель атома натрия
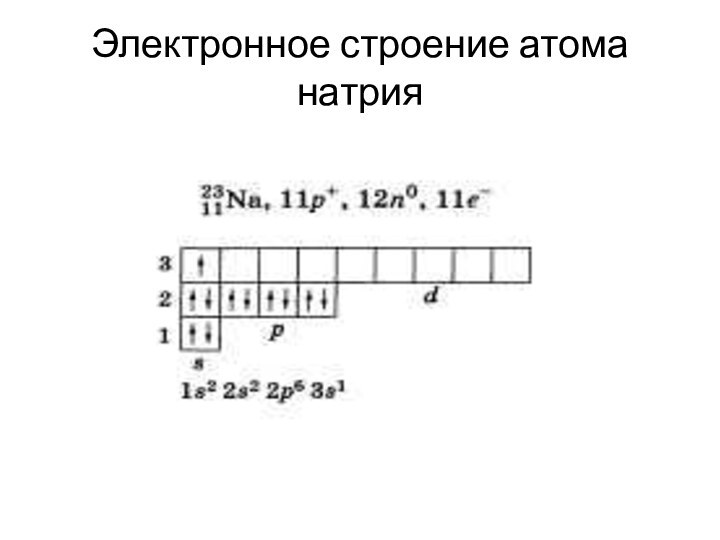
- 10. Электронное строение атома натрия
- 11. Задание 2. Составьте схему электронного строения
- 12. Вывод: 1. Металлы– элементы, имеющие на
- 13. Металлическая химическая связь характеризуется: - делокализацией связи,
- 14. Кристаллические решетки металлов тетрагональнаяТетрагональная объёмноцентрическаяромбоэдрическаягексагональнаякубическаяКубическая объёмноцентрическаяКубическая гранецентрированная
- 15. Видеоинформация о кристаллах металлов
- 16. Свойства металлов определяются строением их атомов.
- 17. Проверьте усвоение знаний на уроке тестированием
- 18. Задания теста 2 и 3
- 19. Задания теста 4 и 5
- 20. Скачать презентацию
- 21. Похожие презентации
Цель урока: 1. на основе положения металлов в ПСХЭ прийти к пониманию особенностей строения их атомов и кристаллов (металлической химической связи и кристаллической металлической решетки). 2.Обобщить и расширить знания о физических свойствах металлов и