- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Кислоты
Содержание
- 2. Кислотами называют сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков.
- 3. Кислотами называют электролиты,которые при диссоциации образуют катионы
- 4. КЛАССИФИКАЦИЯ КИСЛОТ
- 5. кислотыПо содержанию кислорода в кислотном остаткеПо основностикислородныебескислородныеодно-основныедвухосновныетрёхосновныеH3PO4HNO3H2SHClHBrHClHNO3H2SH2SO4H3PO4
- 6. КИСЛОТЫПО РАСТВОРИМОСТИ В ВОДЕПО ЛЕТУЧЕСТИРАСТВОРИМЫЕНЕРАСТВОРИМЫЕЛЕТУЧИЕНЕЛЕТУЧИЕH2SO4H2SHNO3H2SiO3H2SHClHNO3H2SO4H2SiO3H3PO4
- 7. КИСЛОТЫ ПО СТЕПЕНИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИПО СТАБИЛЬНОСТИСИЛЬНЫЕСЛАБЫЕСТАБИЛЬНЫЕНЕСТАБИЛЬНЫЕH2SO4HClHNO3H2S,H2SO3H2SiO3,H2CO3H2SO4H3PO4HClH2SO3H2CO3H2SiO3
- 9. Изменение окраски индикатора в кислой среде
- 11. КИСЛОТА+ОСНОВАНИЕОКСИД МЕТАЛЛАМЕТАЛЛСОЛЬ
- 12. Первая реакция является универсальной реакцией, так как
- 13. Вторая реакция протекает между оксидами металлов и
- 14. Чтобы прошла третья реакция, необходимо выполнить несколько
- 15. 2)должна получиться растворимая соль.Pb + H2SO4 ≠
- 16. Четвёртая реакция является типичной реакцией иного обмена
- 17. Чтобы не подвергать свою жизнь опасности,Надо знать
- 18. Скачать презентацию
- 19. Похожие презентации
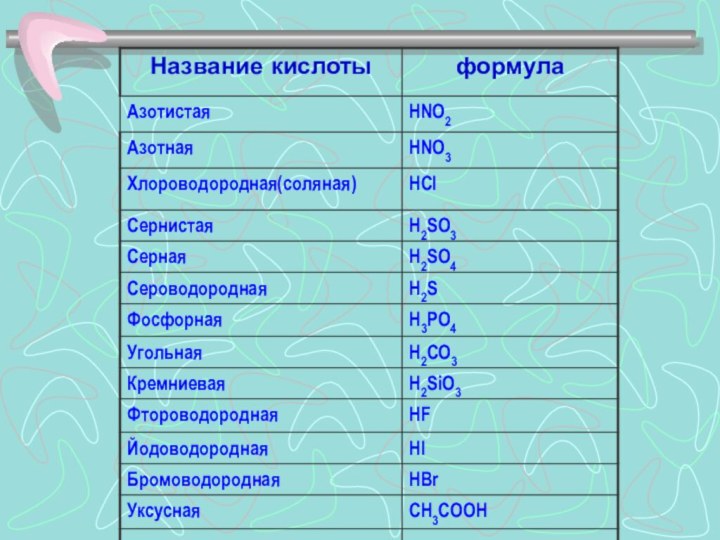
Кислотами называют сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков.















Слайд 2
Кислотами называют сложные вещества, молекулы которых состоят из
атомов водорода и кислотных остатков.
Слайд 3
Кислотами называют электролиты,которые при диссоциации образуют катионы водорода
и анионы кислотного остатка:
HCl = H+ + Cl-,
HNO3 =
H+ + NO3-,H2SO4 = 2H + + SO42-.
Слайд 5
кислоты
По содержанию кислорода в кислотном остатке
По основности
кислородные
бескислородные
одно-основные
двухосновные
трёхосновные
H3PO4
HNO3
H2S
HCl
HBr
HCl
HNO3
H2S
H2SO4
H3PO4
Слайд 6
КИСЛОТЫ
ПО РАСТВОРИМОСТИ В ВОДЕ
ПО ЛЕТУЧЕСТИ
РАСТВОРИМЫЕ
НЕРАСТВОРИМЫЕ
ЛЕТУЧИЕ
НЕЛЕТУЧИЕ
H2SO4
H2S
HNO3
H2SiO3
H2S
HCl
HNO3
H2SO4
H2SiO3
H3PO4
Слайд 7
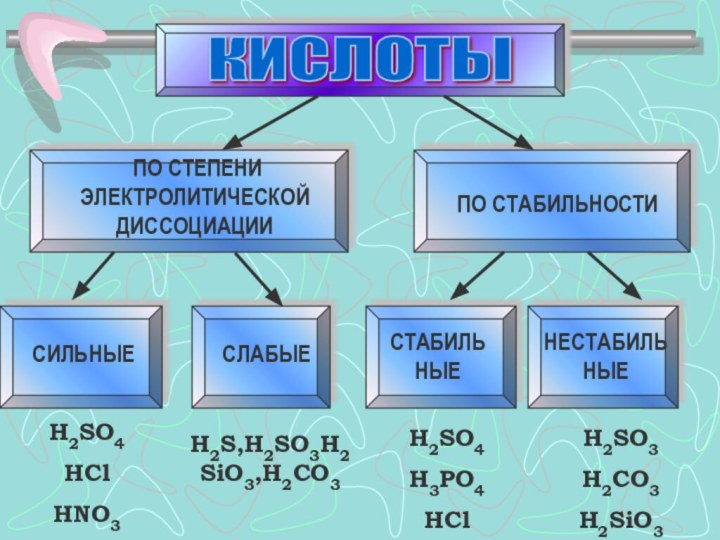
КИСЛОТЫ
ПО СТЕПЕНИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
ПО СТАБИЛЬНОСТИ
СИЛЬНЫЕ
СЛАБЫЕ
СТАБИЛЬНЫЕ
НЕСТАБИЛЬНЫЕ
H2SO4
HCl
HNO3
H2S,H2SO3H2SiO3,H2CO3
H2SO4
H3PO4
HCl
H2SO3
H2CO3
H2SiO3
Слайд 10
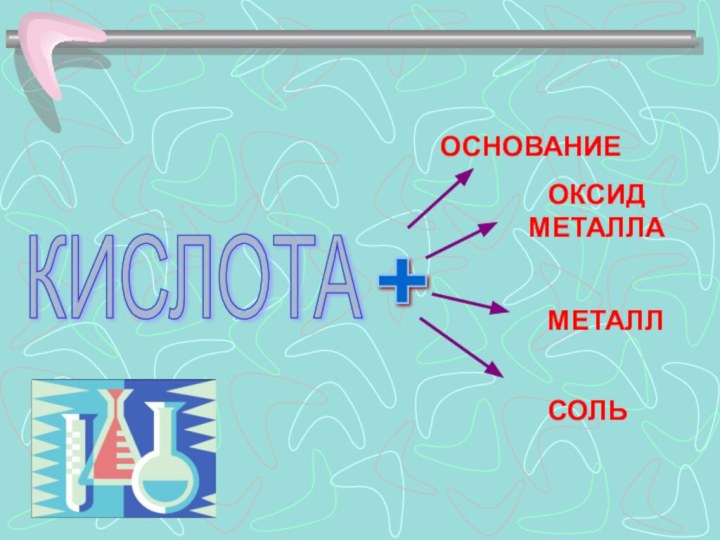
ТИПИЧНЫЕ РЕАКЦИИ КИСЛОТ
КИСЛОТА +
ОСНОВАНИЕ ? СОЛЬ + ВОДА.(РЕАКЦИЯ ОБМЕНА, РЕАКЦИЯ НЕЙТРАЛИЗАЦИИ)
КИСЛОТА + ОКСИД МЕТАЛЛА ? СОЛЬ + ВОДА.
(РЕАКЦИЯ ОБМЕНА)
КИСЛОТА + МЕТАЛЛ ? СОЛЬ + ВОДА.
(РЕАКЦИЯ ЗАМЕЩЕНИЯ)
КИСЛОТА + СОЛЬ ? НОВАЯ КИСЛОТА + НОВАЯ СОЛЬ.
(РЕАКЦИЯ ОБМЕНА)
Слайд 12 Первая реакция является универсальной реакцией, так как она
протекает между любыми кислотами и основаниями. Например, со щелочью
(реакция нейтрализации):HCl + NaCl = NaCl + H2O, или
H+ + OH- = H2O
Аналогично протекает эта реакция и с нерастворимыми основаниями:
2HNO3 + Fe(OH)2 = Fe(NO3) 2 + 2H 2 O, или
2H+ + Fe(OH) 2 = Fe2+ + 2H 2 O.
Слайд 13 Вторая реакция протекает между оксидами металлов и большинством
кислот, например:
CuO + H2SO4 = CuSO4 + H2O,
CuO +
2H+ = Cu2+ + H2O.
Слайд 14
Чтобы прошла третья реакция, необходимо выполнить несколько условий.
1).K,
Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb,
H2, Cu, Hg, Ag, Au.Металл должен находиться в этом ряду до водорода. Например,
Zn + 2HCl = ZnCl2 + H2?,
Zn0 + 2H+ = Zn2++ H20?.
Слайд 15
2)должна получиться растворимая соль.
Pb + H2SO4 ≠ PbSO4?
+ H2?.
3) Эта реакция характерна для растворов кислот, поэтому
нерастворимые кислоты, например кремниевая, не вступают в реакции с металлами.H2SiO3 + Zn ≠
Слайд 16 Четвёртая реакция является типичной реакцией иного обмена и
протекают только в том случае, образуется осадок или газ,
например:H2SO4 + BaCl2 = BaSO4? + 2HCl, или
Ba2++ SO42- = BaSO4?
Приведём пример реакции кислоты с солью, протекающей с выделением газа:
2HNO3 +CaCO3 = Ca(NO3 ) 2 + H 2 O + CO 2?, или
CaCO3 + 2H+ = Ca2+ + H 2 O + CO 2 ?.
Слайд 17
Чтобы не подвергать свою жизнь опасности,
Надо знать технику
безопасности.
Делаешь только то, что положено,
И при этом очень осторожно.
С
едкими веществами (кислоты, щёлочи) работать можно, Но крайне осторожно.Если кислоты или щёлочи на тебя попадают,
Их большим количеством воды немедленно смывают.
Кислоту в воду добавляют –
Только так кислоту разбавляют.





























