Слайд 2
Что даёт нам знание такого предмета, как химия,
и как его применять в жизни?
Это
фото и фото на первом слайде - домашняя хим.лаборатория моего брата, а теперь и моя. Еще пару лет назад я удивлялась - зачем все это? Но теперь, когда за плечами 3 года изучения химии в школе, смело могу сказать: знания химии необходимы для любого человека. Они обязательно помогут в жизни, например, при выборе различных материалов, продуктов питания, образа жизни и т.п.
Здоровье, настроение связаны с бесчисленными химическими веществами и процессами вокруг нас и в нас самих. Химия способствует развитию огромных возможностей, но требует грамотного и серьезного отношения, понимания сущности химических явлений.
Моя задача - показать взаимосвязь химических знаний, быта и здоровья человека.
Слайд 4
Химия на кухне
На наших кухнях можно
найти множество химических веществ. Это и поваренная соль, и
пищевая сода, уксусная и лимонная кислоты, сахар, крахмал и т.п. В своей презентации я расскажу я лишь о нескольких из них. Также на кухнях можно найти продукты, содержащие много органических веществ: жиров (подсолнечное и сливочное масло, например), белка (мясо, рыба, соя), углеводов (хлеб, шоколад…), даже этанола (алкогольные напитки).
Во время приготовления пищи на кухне происходит множество процессов и химических реакций, и я рассмотрела некоторые из них.
Слайд 5
Поваренная соль
Самым распространённым химическим веществом на
наших кухнях является поваренная соль – хлорид натрия(NaCl). Она
широко используется в качестве консерванта и прекрасно растворяется в воде.
Соль участвует в поддержании и регулировании водного баланса в организме. При хронической нехватке соли в организме возможен смертельный исход.
Чрезмерное или просто повышенное потребление соли увеличивает риск сердечно-сосудистых заболеваний, может приводить к повышенному артериальному давлению и болезням почек, нарушению обмена кальция, отложению солей, различным заболеваниям суставов. Наряду с другими солями натрия, поваренная соль может стать причиной заболеваний глаз.
Слайд 6
Химические свойства:
1.Взаимодействие с солями других металлов:
AgNO3 + NaCl → AgCl↓ + NaNO3;
2.Реакция с
концентрированной серной кислотой:
H2SO4(конц.) + NaCl → NaHSO4 + HCl↑
(может использоваться в лаборатории для получения чистой соляной кислоты)
Морская соль помимо NaCl содержит небольшое количество KI (источник йода), MgSO4, CaSO4 и других соединений. Поэтому она считается полезнее обычной поваренной соли.
Слайд 7
Уксусная кислота
Уксусная кислота(CH3COOH) представляет собой
бесцветную жидкость с характерным резким запахом и кислым вкусом;
растворима в воде. Часто используется как приправа к блюдам; в производстве соусов, майонезов, маринадов и т.п.; в консервировании и приготовлении напитков.
Слайд 8
Химические свойства уксусной кислоты:
1.Диссоциация:
Уксусная кислота диссоциирует по
уравнению
СН3СООН +H2O → СН3СОО- + Н3O+
Она
проявляет кислотные свойства, но в меньшей степени, чем большинство неорганических кислот.
2.Взаимодействие с активными металлами (стоящими в ряду напряжения металлов до водорода) с образованием солей - ацетатов:
Mg+ 2CH3COOH → (CH3COO)2Mg + H2↑
3.Взаимодействие с основными оксидами и амфотерными оксидами:
2СН3СООН + МgО →(СН3СОО)2Мg + Н2О,
4.Взаимодействие с основаниями и амфотерными гидроксидами:
2СН3СООН + Zn(ОН)2 → (СН3СОО)2Zn + 2Н2О.
5.Реакция этерификации (получение сложных эфиров из кислот и спиртов в присутствии серной кислоты):
СН3СООН + С2Н5ОН → СН3СООС2Н5 + Н2О
этанол
этилацетат (достаточно распространённый растворитель)
Слайд 9
Решу задачу для мамы
У нас имеется 70%
уксусная кислота, а маме по рецепту приготовления салата нужен
1 стакан (200г) 9% уксуса.
Данную задачу я решила «методом креста»:
70
0
Кислота
Вода
9
61
+
70
- x (сколько нужно взять граммов 70% уксусной к-ты)
- y (сколько нужно взять граммов воды)
x = (9*200)/70 =25,7(г) – столовая ложка и ещё чайная ложка
y= 200 – 25,7 = 174,3(г) – воды
Ответ: нужно взять 1 столовую ложку + 1 чайную ложку уксусной кислоты и долить водой до отметки 200 в мерном стакане.
9
Слайд 10
Пищевая сода
Пищевая сода, гидрокарбонат натрия(NaHCO3) –
белая кристаллическая соль, однако чаще всего она встречается в
виде порошка тонкого помола белого цвета. Сода — помощник на кухне для мытья посуды, тары для консервирования, некоторых плодов и ягод перед сушкой. Она также обладает свойством нейтрализовать и убивать запахи.
Слайд 11
Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной
кислоты.
1.Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами, с соли
и угольной кислоты, которая сразу же распадается на углекислый газ и воду:
NaHCO3 + H+ → Na+ + H2O + CO2↑
2. Реакция с уксусной кислотой часто встречается в кулинарии. При этом образуется ацетат натрия и углекислый газ, разрыхляющий тесто:
NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
3. Разложение при нагревании:
2NaHCO3 → Na2CO3 + CO2 ↑ + H2O
(эта реакция не используется в кулинарии, т.к.
образующийся карбонат натрия при гидролизе
даёт щёлочь)
Слайд 12
Лимонная кислота
Лимонная кислота(C6H8O7) — кристаллическое вещество
белого цвета; хорошо растворимое в воде, растворимое в этиловом
спирте. Вещество чрезвычайно распространено в природе: содержится в ягодах, плодах цитрусовых, хвое, стеблях махорки, особенно много его в китайском лимоннике и недозрелых лимонах.
Лимонная кислота играет важную роль в системе реакций клеточного дыхания множества организмов.
Сама кислота и цитрат натрия широко используются как вкусовая добавка и консервант в пищевой промышленности (пищевая добавка E330).
Слайд 13
Приготовление шипучего напитка
На реакции лимонной кислоты
с питьевой содой основано приготовление «шипучек» - порошков или
таблеток, которые при растворении в воде образуют газированный напиток.
В стакане я смешала ¼ чайной ложки питьевой соды, ½ чайной ложки лимонной кислоты и чайную ложку сахара. Затем я добавила воды, перемешала, и при этом стал выделяться газ, а вода приобрела кисловатый вкус.
Если взять слишком много соды, кислота прореагирует полностью, и напиток будет невкусным. Также можно воспользоваться лимонным соком вместо лимонной кислоты.
Слайд 14
Этанол
Применяется как консервант для хлебобулочных изделий,
как растворитель для пищевых ароматизаторов, а также в кондитерской
промышленности.
Зарегистрирован в качестве пищевой добавки E1510.
Наряду с водой, этанол является необходимым компонентом спиртных напитков. Также в небольших количествах содержится в ряде напитков, получаемых брожением, но не причисляемых к алкогольным (кефир, квас и др.)
В сравнении с другими спиртами, этанол имеет невысокую токсичность, обладая при этом значительным психоактивным эффектом, оказывающим угнетающее действие на центральную нервную систему. Повышенное содержание этанола в крови вызывает опьянение, в результате чего у человека снижается реакция и внимание, нарушается координация движений и мышление.
Слайд 15
Химические свойства:
1. Горение
С2Н5ОН + 3О2 →
2СО2 + 3Н2О
2. Реакции замещения
а) с натрием
2С2Н5ОН + 2Na → 2С2Н5ОNa + Н2
б) с галогеноводородами
С2Н5ОН + НBr → С2Н5Br + Н2О
3. Реакции дегидратации(в присутствии H2SO4)
а) При температуре >140°C:
С2Н5ОН → С2Н4 + Н2О
б) При умеренном нагревании:
С2Н5ОН + С2Н5ОН → С2Н5-О-С2Н5 + Н2О (получение диэтилового эфира)
4.Окисление спиртов:
С2Н5ОН + CuO → Cu + СН3СОН (этаналь) + Н2О
Окисление этанола происходит и в нашем организме под действием ферментов. При этом получается ядовитое вещество этаналь.
Слайд 16
На вопросы кулинара
отвечает химия
Почему глицерин можно
применять в качестве добавки в кондитерские кремы?
Глицерин
сохраняет сладость кремов, делает их нежнее. Кроме того, он препятствует их засыханию, так как сам не испаряется при комнатной температуре (его температура кипения слишком высока) и не дает испаряться воде, удерживая ее за счет образования водородных связей.
Чем объясняется появление едкого запаха от пригоревших жиров?
Запах акролеина хорошо знаком многим хозяйкам, у которых пригорало жаркое. Жиры при слишком высокой температуре разлагаются с образованием глицерина ,а при разложении глицерина образуется непредельный альдегид — акролеин (пропеналь), обладающий резким раздражающим запахом.
Слайд 18
Химия в ванной
Заглянем в ванную комнату. В
состав моющих и чистящих средств входят разнообразнейшие химические вещества:
кислоты, щёлочи, соли, органические вещества. В своей презентации я рассмотрела ацетон, гидроксид натрия, обратила внимание на состав стиральных порошков и других средств бытовой химии.
Слайд 19
Ацетон
Ацетон (диметилкетон,пропанон-2) — простейший представитель
кетонов, бесцветная легкоподвижная летучая жидкость с характерным запахом. Он
смешивается с водой и большинством органических растворителей. Ацетон хорошо растворяет многие органические вещества. Широко используется как растворитель, в том числе и в жидкостях для снятия лака.
Слайд 20
Ацетон огнеопасен, т.к. очень легко воспламеняется (на видео
– горение ацетона):
Слайд 21
Гидроксид натрия
NaOH, едкий натр. Используется как
основной компонент средств для растворения засоров канализационных труб (например,
«Крот»), входит в состав средств для мытья плит, т.к. хорошо растворяет жир. В небольших количествах встречается в составе некоторых косметических средств.
Гранулы NaOH
Слайд 22
Химические свойства:
Гидроксид натрия — сильное основание (щёлочь)
1.Взаимодействие с
кислотами:
NaOH + HCl → NaCl + H2O
2.Взаимодействие
с кислотными и амфотерными оксидами:
SO2 + 2NaOH → Na2SO3 + H2O
ZnO + 2NaOH → Na2Zn(OH)4 + H2O
3.С неметаллами:
3Si + 6NaOH + 3Н2О → 3Na2SiO3+6H2
4.С активными металлами: (алюминием, цинком и др.):
2Al + 2NaOH + 6H2O → 3H2↑ + 2Na[Al(OH)4]
5. Со спиртами (в результате реакции образуются алкоголяты):
HOCH2-CH2ОН + 2NaOH → NaOCH2-CH2ONa + 2Н2O
Слайд 23
Стиральные порошки
В синтетических моющих средствах широко используются фосфаты.
Они связывают ионы кальция и магния.
Фосфаты, попадающие в
окружающую среду, приводят к зарастанию водоемов и отравлениям. Наличие фосфатных добавок в порошках также приводит к значительному усилению отрицательных свойств анионных ПАВ. Поэтому использование фосфатов в стиральных порошках запрещено во многих странах. В странах ЕС обсуждается запрет на использование фосфатов с 2011 года.
У нас в стране фосфатный порошок не запрещён, причем концентрация этих добавок доходит до 50-60 %. Производители пытаются таким образом усилить очищающие свойства порошка.
Слайд 24
Индикаторы
H2SO4
Лимонная
кислота
Питьевая
сода
Щёлочь
Горячая
вода
Дистиллированная
вода (образец)
«Мистер мускул»
Стиральный
порошок
Жидкость
для мытья
плит
Гель для
душа
«Крот»
С
помощью индикаторов можно определить, насколько данное средство опасно для
кожи и можно ли его применять без защитных перчаток. Я приготовила растворы нескольких средств бытовой химии и добавила к ним по нескольку капель универсального индикатора. Жидкость для мытья плит и «Крот» имеют сильнощелочную среду, губительную для кожи, а «Мистер Мускул» по кислотности уступает даже лимонной кислоте и потому не очень опасен.
Слайд 25
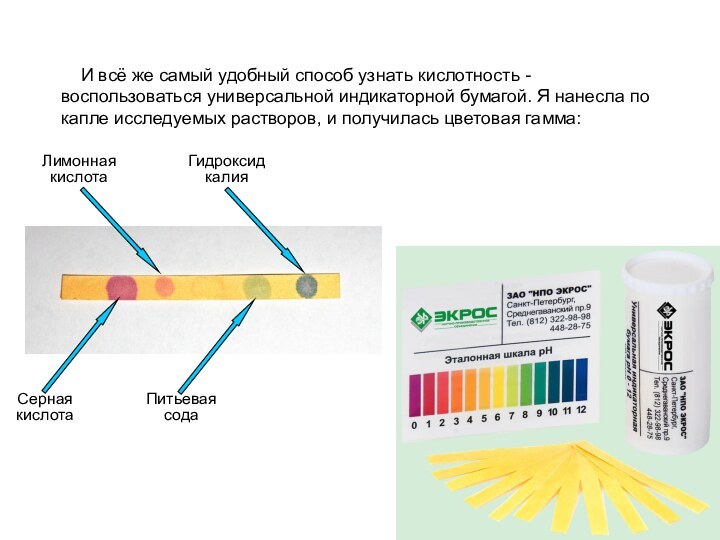
И всё же самый удобный способ
узнать кислотность -воспользоваться универсальной индикаторной бумагой. Я нанесла по
капле исследуемых растворов, и получилась цветовая гамма:
Серная кислота
Питьевая сода
Лимонная кислота
Гидроксид калия
Слайд 26
Самодельные индикаторы
Я решила попробовать приготовить индикаторы
самостоятельно. Самый простой - это заварка чая. При добавлении
лимона чай светлеет, а значит является индикатором кислой среды.
Выполнить роль индикатора может даже борщ. Чтобы свекольный борщ был ярко-красным, в него перед окончанием варки я добавляю немного пищевой кислоты - уксусной или лимонной. Цвет меняется буквально на глазах.
На изменение кислотности четко реагируют изменением цвета некоторые соки (вишнёвый, черносмородиновый), черничный и черносмородиновый компоты, некоторые сорта вин.
Слайд 27
Цветы фиалки, ириса, анютиных глазок, тюльпана(тёмные)
способны менять свой цвет в ответ на то или
иное воздействие.
Я проделала следующий опыт: цветок фиалки опускала в различные среды. Результаты опыта: В нейтральной среде цветок сиреневой фиалки своего цвета не изменяет. В щелочной среде он становится жёлтым, а в кислой – розовым.
Слайд 29
Химия в аптечке
Изучим содержимое аптечки. Здесь
очень много известных по урокам химии веществ – йод,
нашатырный спирт, марганцовка, перекись водорода, глицерин, активированный уголь и многое другое.
Слайд 30
Глицерин
Глицерин — HOCH2-CH(OH)-CH2OH,
трёхатомный спирт. Представляет
собой бесцветную вязкую жидкость, хорошо растворимую в воде и
сладкую на вкус.
Широко применяется в изготовлении косметики и мыл. Ранее считалось, что глицерин хорош для смягчения кожи человека, однако в последнее время не все косметологи разделяют это мнение. В медицине применяется как слабительное и смягчающее средство.
Слайд 31
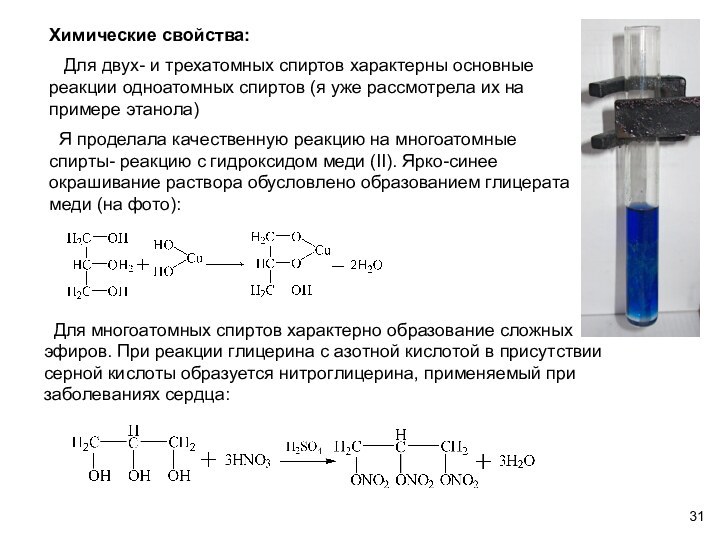
Химические свойства:
Для двух- и трехатомных спиртов
характерны основные реакции одноатомных спиртов (я уже рассмотрела их
на примере этанола)
Я проделала качественную реакцию на многоатомные спирты- реакцию с гидроксидом меди (II). Ярко-синее окрашивание раствора обусловлено образованием глицерата меди (на фото):
Для многоатомных спиртов характерно образование сложных эфиров. При реакции глицерина с азотной кислотой в присутствии серной кислоты образуется нитроглицерина, применяемый при заболеваниях сердца:
Слайд 32
Перманганат калия
Калия перманганат,KMnO4(марганцовка) — калиевая соль марганцевой
кислоты. Представляет собой тёмно-фиолетовые кристаллы.
Разбавленные растворы (около
0,1%) перманганата калия нашли широчайшее применение в медицине как антисептическое средство, для полоскания горла, промывания ран, обработки ожогов, приёма внутрь при некоторых отравлениях (обладает рвотным действием).
Щелочной раствор перманганата калия хорошо отмывает лабораторную посуду от жиров и других органических веществ.
Слайд 33
Химические свойства:
1.KMnO4 – очень сильный окислитель.
Он окисляет различные вещества, восстанавливаясь до соединений марганца разной
степени окисления. Примеры окислительных реакций приведены ниже:
в кислой среде: 2KMnO4 + 5K2SO3 + 3H2SO4 → 6K2SO4 + 2MnSO4(бесцв.) + 3H2O
в нейтральной среде: 2KMnO4 + 3K2SO3 + H2O → 3K2SO4 + 2MnO2 + 2KOH
в щелочной среде: 2KMnO4 + K2SO3 + 2KOH → K2SO4 + 2K2MnO4(зелёный)+ H2O
Слайд 34
2. При нагревании перманганат разлагается с выделением
кислорода (этим способом пользуются в лаборатории для получения чистого
кислорода):
2KMnO4 →(t°) K2MnO4 + MnO2+ O2↑
3.При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном добавлении холодной кислоты образует неустойчивый оксид марганца(VII), окисляющий всё подряд:
2KMnO4 + 2H2SO4 → 2KHSO4 + Mn2O7 + H2O
4.Перманганат калия окисляет и некоторые органические вещества, например, ацетилен:
В результате моего опыта (на видео) видно, что в кислой среде перманганат калия обесцвечивается, а значит, я могу выводить пятна от марганцовки кислотой (например, лимонной).
На следующем видео показана реакция перманганата калия с серной кислотой. Не рекомендуется также смешивать её со средствами, содержащими соляную кислоту, т.к. при этом выделяется ядовитый хлор.
Слайд 36
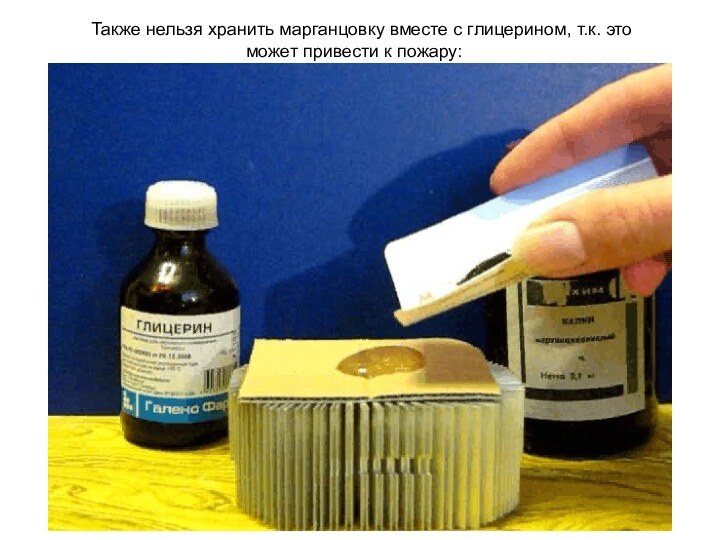
Также нельзя хранить марганцовку вместе с
глицерином, т.к. это может привести к пожару:
Слайд 37
Йод
Йод(I2) относится к галогенам; при комнатной
температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. Пары
имеют характерный фиолетовый цвет, а спиртовой раствор йода – бурый.
5%-ный спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения, но не для приёма внутрь при дефиците йода в организме. Отсутствие или недостаток йода в рационе приводит к заболеваниям.
Слайд 38
Химические свойства:
Йод довольно активен, хотя и в меньшей
степени, чем хлор и бром.
1.С металлами (даже
неактивными) йод при легком нагревании энергично взаимодействует, образуя йодиды.
Hg + I2 = HgI2
2. При растворении в воде йод частично реагирует с ней:
I2 + H2O = HI + HIO
3. При нагревании йод взаимодействует с фосфором:
3I2 + 2P = 2PI3
4. Йод, как окислитель, взаимодействует с различными восстановителями:
H2SO3 + I2 + H2O = H2SO4 + HI
H2S + I2 = 2HI + S
Слайд 39
Я показала на опытах, что химия
может быть коварной, если не соблюдать элементарных правил предосторожности.
Все средства бытовой химии (даже если это обычная сода или стиральный порошок) должны храниться в закрытой упаковке отдельно от пищевых продуктов, в местах, недоступных для детей и животных.
Пожароопасные средства (ацетон, скипидар и т.п.) должны стоять далеко от источников тепла или огня в закрытых склянках.
При работе со средствами, содержащими агрессивные химические вещества (соляную кислоту, щёлочи и др.) необходимо надевать резиновые перчатки и беречь глаза.
Мои выводы
Слайд 40
Необходимо иметь ввиду, что некоторые
вещества при смешении реагируют друг с другом, иногда выделяя
большое количество тепла, что ведёт к кипению и разбрызгиванию или вспышкам и самовоспламенению. Также некоторые вещества после смешивания с другими изменяют свои свойства, становясь непригодными к употреблению. Поэтому нужно тщательно следить за порядком в аптечке или шкафчике, где у вас хранятся химические вещества. Нашатырный спирт и нашатырь лучше держать подальше от формалина и йода. Серную и соляную кислоты – от питьевой соды, мела, щелочей. Перманганат калия воспламеняет глицерин, спирт.
При попадании на кожу кислоты нужно промыть поражённое место раствором 3%-ным раствором питьевой соды, а затем водой.
При поражении щелочами поражённое место тоже нужно обработать 3%-ным раствором лимонной или уксусной кислоты и хорошо промыть водой (т.к. щёлочи мылкие и плохо смываются)
Слайд 41
Данный проект может использоваться учителем на уроках химии

в любом классе: в 8-м - при прохождении темы
«Классы неорганических веществ»и «Первоначальные химические понятия», в 9-м – «Соединения углерода», 10-м – «Кислородосодержащие вещества», в 11-м – «Химия и жизнь».
В дальнейшем я планирую продолжать изучение химии, ведь впереди ещё целый год учёбы. Я могла бы провести больше опытов в домашних условиях, имей в своём распоряжении нужные реактивы. Проект очень актуален в наши дни, ведь современную жизнь уже невозможно представить без химии. Моя работа обязательно будет дополняться новыми опытами и выводами с приобретением химических знаний
Все видео и большинство фото в презентации сделаны мной (опыты проводились под присмотром взрослых).
Все фото, встречающиеся в презентации, прошли обработку в графическом редакторе Photoshop, часть проявлена с помощью Raw Therapee. Видео редактировалось в VirtualDub. Структурные формулы органических веществ были нарисованы мной самостоятельно, в программе ChemDraw.