Слайд 2
Состав атомного ядра
Ядро атома состоит из протонов и
нейтронов (нуклоны)
Суммарное число протонов Z и нейтронов N в
ядре атома называют массовым числом А:
A= Z+N
Это уравнение связывает между собой три характеристики: число протонов, число нейтронов и массовое число.
Слайд 3
В ядре сосредоточена почти вся масса атома, т.к.
масса электронов очень маленькая величина
Слайд 4
Состав атомного ядра
Массовое число-целочисленное значение;
число Z= атомному номеру
элемента в Периодической системе ,т.е заряду ядра атома;
Число электронов=
числу протонов
Слайд 5
Нуклиды
Нукли́д (лат. nucleus — «ядро» и др.-греч. είδος — «вид, сорт») —
вид атомов, характеризующийся определённым массовым числом, атомным номером
Слайд 7
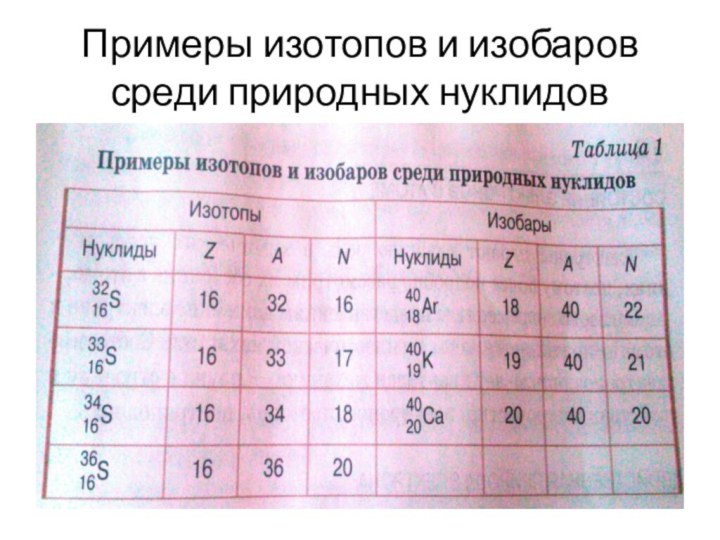
Изотопы
Изотопы- атомы (нуклиды) одного и того же химического
элемента, имеющие одинаковый заряд ядра, но разные массовые числа.
Изотопы
одного и того же элемента имеют одинаковое число протонов и электронов, а отличаются друг от друга только числом нейтронов.
Слайд 9
Изобары
Изобары- это атомы (нуклиды), разных элементов имеющие одинаковые
массовые числа, но различные заряды ядер
Слайд 10
Примеры изотопов и изобаров среди природных нуклидов
Слайд 12
Состояние электрона в атоме
Электрон в атоме не имеет
определённой траектории, в качестве модели состояния электрона в атоме,
принято представление об электронном облаке:
электронное облако
не имеет четких границ, т.к.
Электрон может быть обнаружен
Даже на относительно большом
расстоянии от ядра.
Слайд 13
Атомная орбиталь
Атомная орбиталь-пространство вокруг ядра атома, в котором
наиболее вероятно пребывание электрона
Слайд 14
Квантовые числа
1. Главное квантовое число n- характеризует энергию
электрона данного энергетического уровня и определят размеры электронного облака;
оно принимает целочисленные значения от 1 до бесконечности : n=1,2,3,4,5,….,∞
Энергетический уровень составляют орбитами и электроны с одинаковым значение главного квантового числа
Чем
Слайд 15
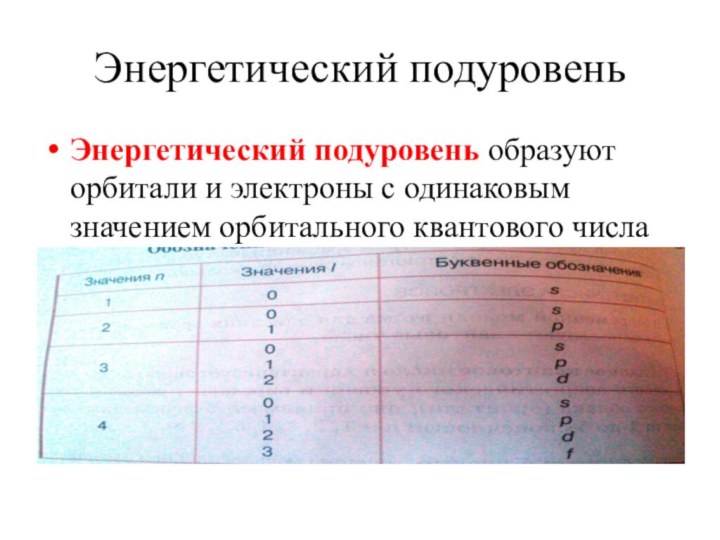
Орбитальное (побочное или азимутальное ) квантовое число
2.Орбитальное квантовое
число l –характеризует энергию данного подуровня и определяет форму
электронного облака, оно принимает целочисленные значения от 0 до (n-1)
Слайд 16
Обозначения энергетических подуровней
Слайд 17
Каждому значению орбитального числа, соответствует своя форма электронного
облака
Слайд 18
Энергетический подуровень
Энергетический подуровень образуют орбитали и электроны с
одинаковым значением орбитального квантового числа
Слайд 19
Энергетический подуровень
Электроны s подуровня-это s электроны
Электроны p подуровня-это
p электроны
Электроны d подуровня-это d электроны
Электроны f подуровня-это f
электроны
При данном значении n наименьшей Е обладают s электроны
Слайд 20
Размеры орбиталей одной и той же формы
Слайд 21
Магнитное квантовое число
Магнитное квантовое число m1 -характеризует
ориентацию атомной орбитали в пространстве относительно внешнего магнитного или
электрического поля, оно принимает целочисленные значения – « +» и « -» в пределах от –l через 0 до + l, всего (2l+1)
Слайд 22
Значения магнитного квантового числа
Слайд 23
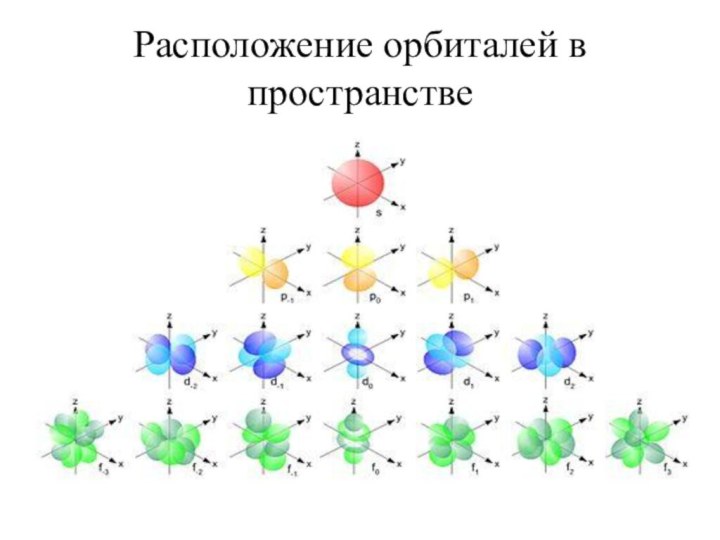
Расположение орбиталей в пространстве
Слайд 24
Вывод
Таким образом, каждая орбиталь и электрон, который находится
на этой орбитали, характеризуется квантовыми числами n, l, m1
. Они определяют форму и ориентацию орбиталей в пространстве.
Слайд 25
Спиновое квантовое число
Спиновое квантовое число m s
-введено для характеристики спина, принимает только два значения ms
= ± ½ . Это позволяет различать электроны, занимающие одну и ту же орбиталь
Если на орбитали один электрон его называют-неспаренный, если два- то это спаренные электроны
Слайд 27
Принцип Паули
Принцип Паули- в атоме не может быть
более двух электронов с одинаковыми значениями всех четырех квантовых
чисел
Слайд 28
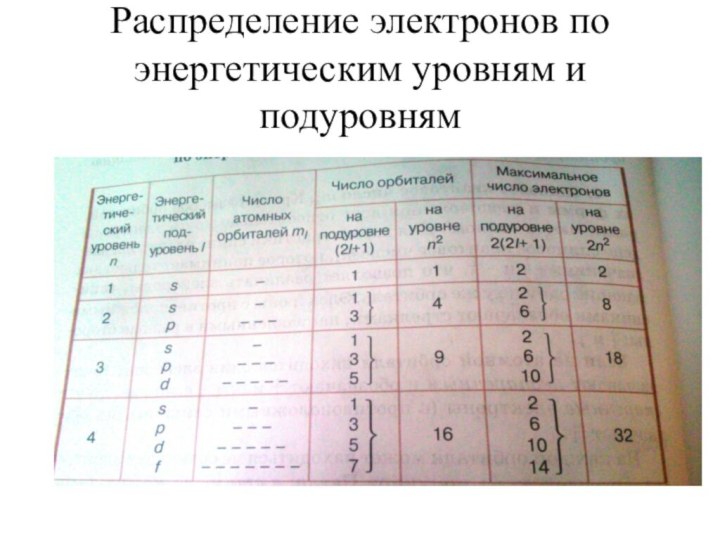
Распределение электронов по энергетическим уровням и подуровням