Слайд 2
УДК 546.04
ББК 24.1
Рецензент: д.х.н. Киселев Ю.М. (химический факультет
МГУ)
Рекомендовано к изданию кафедрой неорганической химии МИТХТ
(протокол №
3 от 10.11.2010)
Е.В. Савинкина 2010
МИТХТ им. М.В. Ломоносова 2010
Утверждено Библиотечно-издательской комиссией МИТХТ им. М.В.Ломоносова в качестве учебного пособия для студентов 1 курса бакалавриата по направлениям 020100 62 (Химия), 240100 62 (Химическая технология и биотехнология), 150600 62 (Материаловедение и технология новых материалов), 280200 (Защита окружающей среды), 200500 62 (Метрология, стандартизация и сертификация), 080500 (Менеджмент).
Один оптический диск
Объем данных 0,9 Мб
Слайд 3
Растворы
Общие свойства растворов
Слайд 4
Вещество А + вещество В
Раствор – гомогенная система,
состоящая из двух или более компонентов,
имеющая переменный состав
Слайд 5
Смеси веществ
Смеси
Грубодисперсные системы (взвеси)
Тонкодисперсные системы (коллоидные системы)
Истинные растворы
Размеры
частиц
более 100 нм
1 – 100 нм
менее 1 нм
Слайд 6
Грубодисперсные системы
Дисперсионная среда – газообразная
Дисперсная фаза:
твердая –
пыль, дым, порошок
жидкая – смог, облако, туман
Дисперсионная среда –
жидкая
Дисперсионная фаза:
твердая – суспензия, паста
жидкая – эмульсия
газообразная – пена, газированная вода
Дисперсионная среда – твердая
Дисперсная фаза:
твердая – горные породы, цветные стекла, композиты
жидкая – твердые эмульсии
газообразная – твердые пены
Слайд 7
Истинные растворы
Агрегатное состояние: газообразные, жидкие, твердые растворы
Состав раствора:
растворитель + растворенное вещество
Параметры раствора: температура, давление, содержание растворенного
вещества
Слайд 8
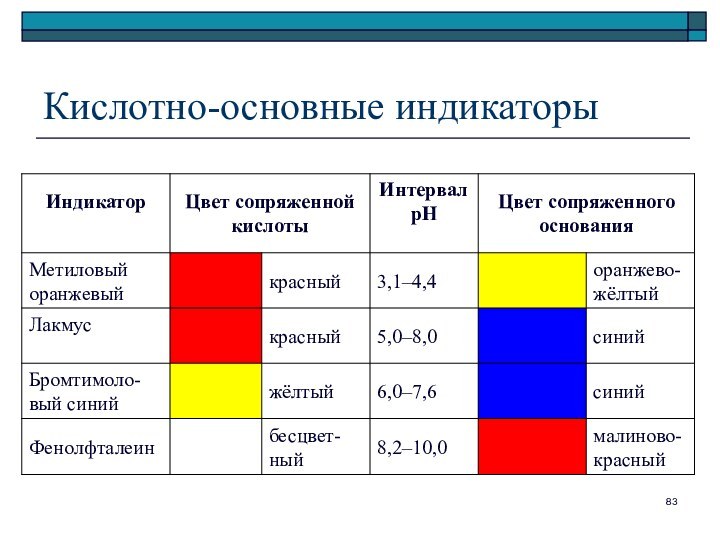
Количественный состав раствора
Массовая доля
Молярная концентрация (молярность)
Эквивалентная концентрация (нормальность)
Коэффициент
растворимости
Мольная доля
Массовая концентрация
Моляльная концентрация (моляльность)
Слайд 9
Растворы
Идеальные
ΔV = 0; ΔQ = 0
Реальные
ΔV ≠ 0
1
л H2O + 1 л C2H5OH → 1,93 л
раствора
ΔQ ≠ 0
Qрастворение = – Qразрыв связей + Qобразование связей
Слайд 10
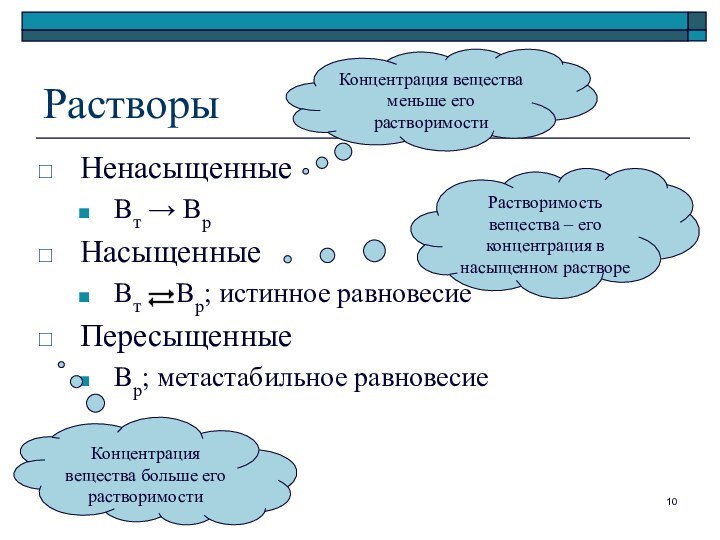
Растворы
Ненасыщенные
Вт → Вр
Насыщенные
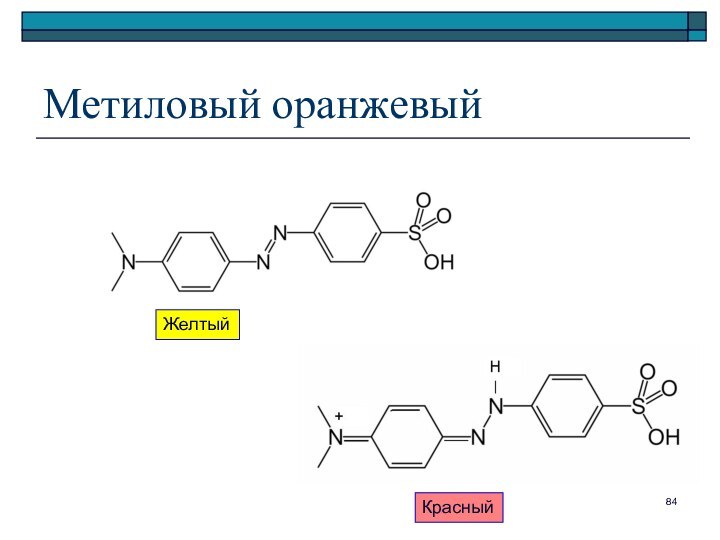
Вт Вр; истинное
равновесие
Пересыщенные
Вр; метастабильное равновесие
Концентрация вещества меньше его растворимости
Концентрация вещества больше
его растворимости
Растворимость вещества – его концентрация в насыщенном растворе
Слайд 11
Растворимость газов в жидкостях
Если нет химического взаимодействия
Ar(г)
Ar(р)
Влияние давления
= 1 0 (принцип
Ле Шателье)
Увеличение давления →
(растворимость увеличивается)
Уменьшение давления ←
(растворимость уменьшается)
Слайд 12
Растворимость газов в жидкостях
Влияние температуры
Qразрыв связей ≈ 0
Qобразование
связей > 0
Процесс экзотермический (принцип Ле Шателье)
Уменьшение температуры
→
(растворимость увеличивается)
Увеличение температуры ←
(растворимость уменьшается)
Qрастворение > 0
Слайд 13
Растворимость газов в жидкостях
Если есть химическое взаимодействие
Cl2(г)
Cl2(р)
Cl2(р) + 2Н2О Н3О+ + Cl
+ НClО
НClО + Н2О Н3О+ + ClО
Слайд 14
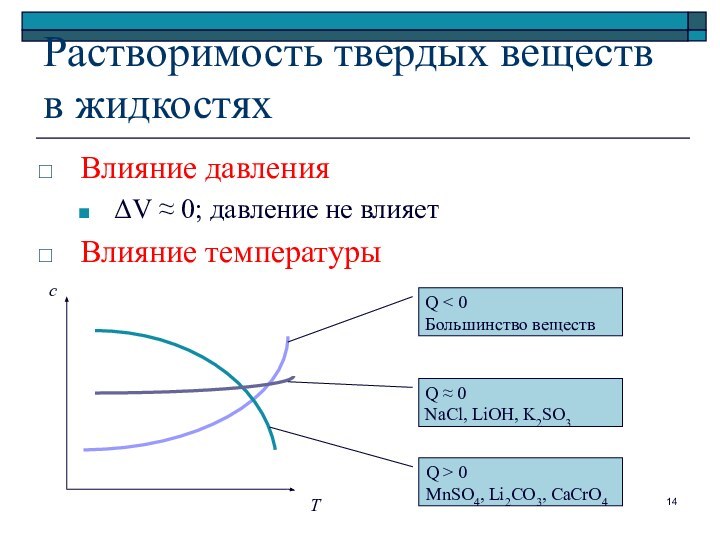
Растворимость твердых веществ в жидкостях
Влияние давления
ΔV ≈ 0;
давление не влияет
Влияние температуры
Т
с
Q < 0
Большинство веществ
Q ≈ 0
NaCl,
LiOH, K2SO3
Q > 0
MnSO4, Li2CO3, CaCrO4
Слайд 15
Диаграмма растворимости
Т
с
Тпл
Ткип
Граница области метастабильных
пересыщенных растворов
Область пересыщенных растворов
c(B) > [B]
Кривая растворимости
c(B) = [B]
Область ненасыщенных растворов
c(B) < [B]
Слайд 16
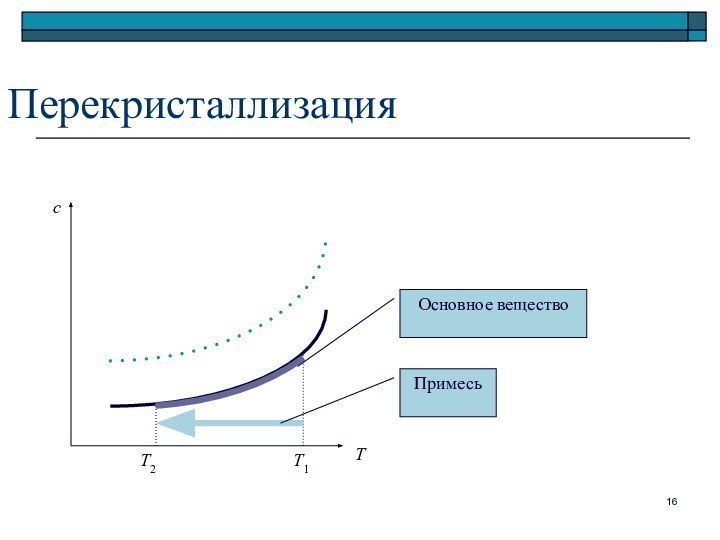
Перекристаллизация
Т
с
Т2
Т1
Основное вещество
Примесь
Слайд 17
Растворы электролитов
Электролитическая диссоциация
Слайд 18
Сильные электролиты
MA M+(р) + A–(р)
[MA] =
0, [M+] = [A–] = c0
Степень диссоциации:
Слайд 19
Слабые электролиты
MA MA(р) + M+(р) + A–(р)
[MA] > 0, [M+] = [A–] < c0
Степень диссоциации:
Слайд 20
Слабые электролиты
MxAy(р) x Ma+(р) + y
Ab–(р)
Константа диссоциации KD
Слайд 21
Закон разбавления Оствальда
МА М+ +
А–
[M+] [A–]
KD = –––––––––
[MA]
[M+] = [A–] = c0
[MA] = (1 – ) c0
KD = 2 c0 / (1 – )
если << 1 ( < 0,05)
KD = 2 c0
α
c0
1
Слайд 22
Гетерогенные ионные равновесия
М+ + А–
МА(т)
МА(т) М+ + А–
Для малорастворимых сильных электролитов:
Kс = [M+][A–] = ПР(МА)
(произведение растворимости)
В общем виде:
МхАу(т) х Ма+ + у Аb–
Тогда ПР = [Ma+]x [Ab–]y
ПР = const при T = const
ПР = f(T)
Слайд 23
Растворимость (L), моль/л
МхАу(т) х Ма+
+ у Аb–
[Ma+] = x L; [Ab–] = y
L
ПР(МхАу) = (x L)x (y L)y = xx yy Lx+y
Слайд 24
Задача
Рассчитать растворимость сульфата серебра, если ПР(Ag2SO4) = 1,2
. 10–5
Ag2SO4(т) 2Ag+ + SO42–
L
2L L
ПР = [Ag+ ]2 [SO42–] = (2L)2L = 4L3
Т
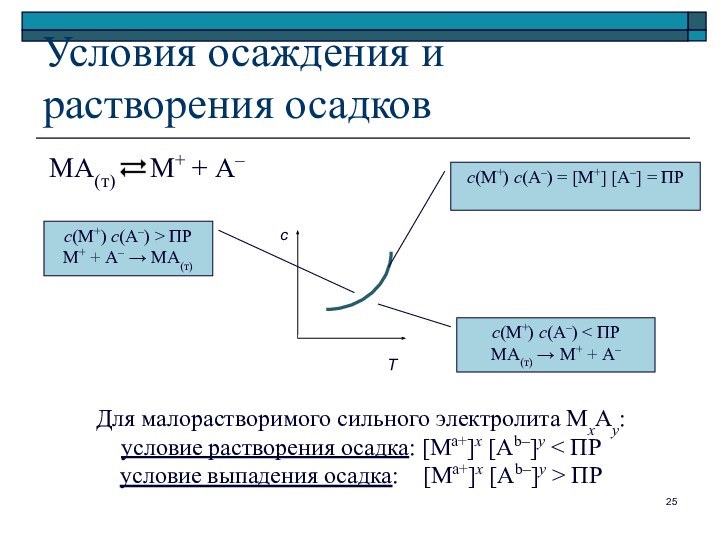
Условия осаждения и растворения осадков
с
с(М+) с(А–) = [M+] [А–] = ПР
с(М+) с(А–) < ПР
МА(т) М+ + А–
с(М+) с(А–) > ПР
М+ + А– МА(т)
МА(т) М+ + А–
Для малорастворимого сильного электролита МхAy
условие растворения осадка: [Ma+]x [Ab–]y < ПР
условие выпадения осадка: [Ma+]x [Ab–]y > ПР
Слайд 26
Введение одноименного иона
МхАу(т) х Ма+
+ у Аb–
Увеличение с(Ма+) или с(Аb–)
Сдвиг равновесия в сторону
образования осадка
Слайд 27
Удаление одноименного иона
МхАу(т) х Ма+
+ у Аb–
Уменьшение с(Ма+) или с(Аb–)
Сдвиг равновесия в сторону
растворения осадка
Слайд 28
Удаление одноименного иона
Связывание в виде менее растворимого вещества
(осадок AgCl осадок AgI)
Связывание
в виде комплексного иона (осадок PbSO4 [Pb(OH)4]2–)
Перевод в другую форму
(осадок BaCrO4 Cr2O72–)
PO43–
Ag2SO4(т) Ag3PO4(т)
SO42–
3 Ag2SO4(т) + 2 PO43– 2 Ag3PO4(т) + 3 SO42– (1)
KС = [SO42–]3 / [ PO43–]2
ПР1 = [Ag+]2[SO42–]
ПР2 = [Ag+]3[ PO43–]
(1) = 3(2) – 2(3)
KС = (ПР1)3 / (ПР2)2 ~ (10–5)3/(10–18)2 > 1
Ag2SO4(т) 2Ag+ + SO42– (2)
Ag3PO4(т) 3Ag+ + PO43– (3)
Слайд 30
В каком минимальном объеме воды можно растворить 1
г гипса?
Условие задачи
V(H2O) = ?
m(CaSO4.2H2O) = 1 г
ПР(CaSO4)
= 4.10–5
M(CaSO4.2H2O) = 172 г/моль
Уравнение фазового равновесия
Са2+ + SО42– CaSO4(т)
ПР(CaSO4) = [Ca2+] [SO42–] = c2
__
V(H2O) = n / c = m / (M c) = m / (M ПР) ~ 0,920 л
Слайд 31
Выпадет ли осадок при сливании равных объемов миллимолярных
растворов нитрата серебра(I) и хлорида натрия?
12 c0(AgNO3)
1/2 c0(NaCl) = 2,510–7 > ПР(AgCl)
Для малорастворимого сильного электролита МхAy
условие выпадения осадка: [Ma+]x [Ab–]y > ПР
c0(AgNO3) = c0(NaCl) = 1.10–3 моль/л
V(p.AgNO3) = V(p.NaCl)
ПР(AgCl) = 1,7810–10
После смешивания растворов:
c(Ag+) = c0(Ag+) V(p.AgNO3) / (V(p.AgNO3) + V(p.NaCl)) =
= 1/2c0(Ag+) = 1/2c0(AgNO3)
c(Cl–) = 1/2c0(Cl–) = 1/2c0(NaCl)
Осадок выпадет
Слайд 32
Протолитическая теория кислот и оснований
1923 г.
Йоханес Брёнстед
Томас Лаури
Слайд 33
Протолитическая теория
кислотные или основные свойства частиц обусловлены
их способностью отдавать или присоединять катион водорода (протон Н+)
NH4+ + S2– NH3 + HS–
Кт Ос Ос Кт
Пары "сопряженная кислота / сопряженное основание":
NH4+/NH3 и HS –/ S2–
Н+
Н+
Слайд 34
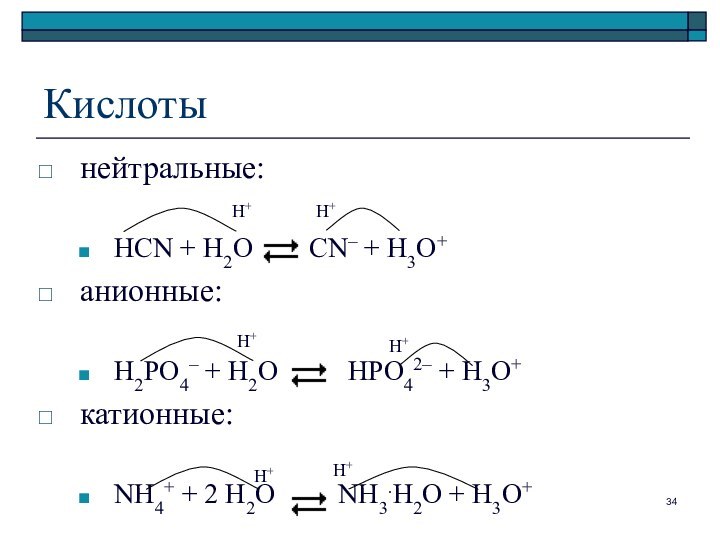
Кислоты
нейтральные:
HCN + H2O CN– +
H3O+
анионные:
H2PO4– + H2O HPO42– +
H3O+
катионные:
NH4+ + 2 H2O NH3.H2O + H3O+
H+
H+
H+
H+
H+
H+
Слайд 35
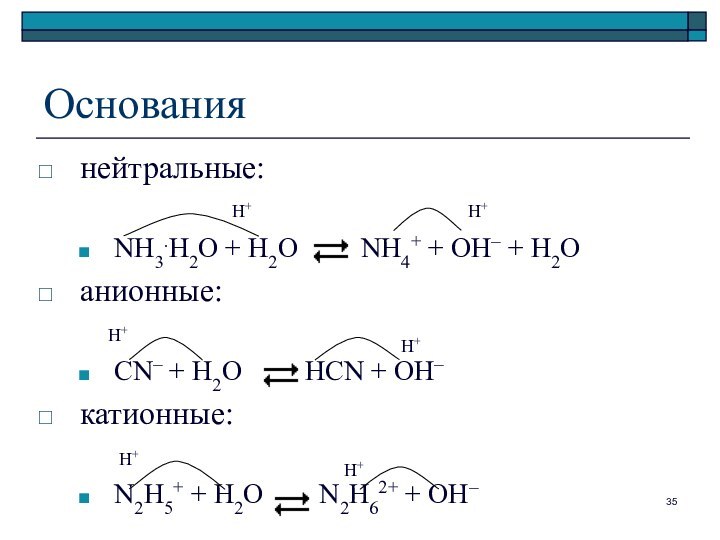
Основания
нейтральные:
NH3.H2O + H2O NH4+
+ OH– + H2O
анионные:
CN– + H2O
HCN + OH–
катионные:
N2H5+ + H2O N2H62+ + OH–
H+
H+
H+
H+
H+
H+
Слайд 36
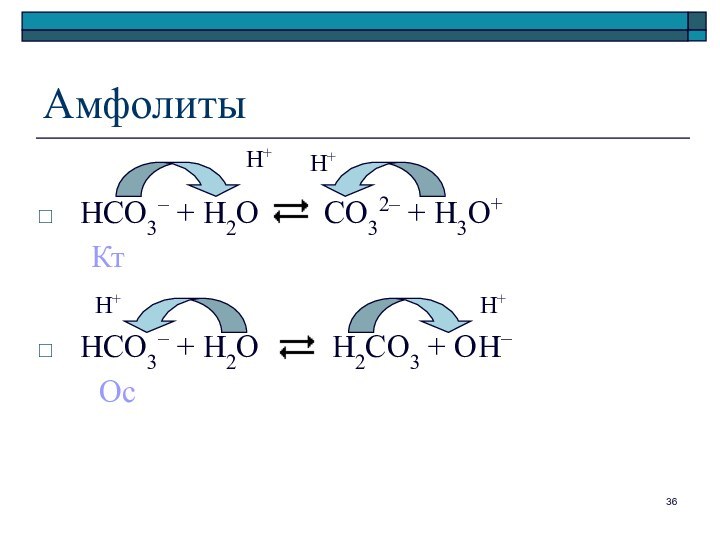
Амфолиты
HCO3– + H2O CO32– +
H3O+
Кт
HCO3– + H2O
H2CO3 + OH–
Ос
Н+
Н+
Н+
Н+
Слайд 37
Растворители
Апротонные:
C6H6, CS2, CCl4
Протонные
H2O, NH3, C2H5OH
(амфолиты)
Автопротолиз:
HL + HL
H2L+ + L–
Константа автопротолиза (ионное произведение):
KS = [H2L+]
[L–]
H+
H+
Слайд 38
Ионное произведение воды
H2O + H2O
H3O+ + OH–
При стандартной температуре 298 К (25
С):
KB (Kw) = [H3O+] [OH–] = 1.10–14
В чистой воде при 25 С
[H3O+] = [OH–] = KB = 10–7 моль/л
H+
H+
Слайд 39
Водородный показатель (рН)
рН = –lg[H3O+]
[H3O+] = 10–рН
Гидроксидный показатель (рОН)
pOH = –lg[OH–]
[OH–] = 10–рОН
рН + рОН = –lgKB = 14
Слайд 40
Водородный показатель (рН)
В чистой воде при 25С
рН =
рОН = 7
Среда нейтральная
Если [H3O+] > 1.10–7, то рН
< 7
Среда кислотная
Если [OH–] > 1.10–7, то рОН < 7 и pH > 7
Среда щелочная
Слайд 41
Шкала рН
При [H3O+] = 0,1 моль/л
(например, в
0,1 М растворе HCl)
pH = 1 (нижний предел).
При
[OH–] = 0,1 моль/л
(например, в 0,1 М растворе KOH)
рН = 13 (верхний предел).
Слайд 42
Константа кислотности
HA + H2O
A– + H3O+
H+
H+
Слайд 43
B(OH)3.H2O + H2O
[B(OH)4]– + H3O+
Слабые кислоты
Сопряженная пара KК
СН3СООН / СН3СОО– 1,7.10–5
Al3+.H2O /
AlOH2+ 9,6.10–6
H2S / HS– 1,1.10–7
B(OH)3.H2O/[B(OH)4]– 5,8.10–10
Сила кислоты
СН3СООН + Н2О СН3СОО– + H3O+
Al3+.H2O + H2O AlOH2+ + H3O+
H2S + H2O HS– + H3O+
Слайд 44
Сильные кислоты
HA + H2O = A– + H3O+
Бескилородные
кислоты: HCl, HBr, HI
Кислородсодержащие кислоты состава НхЭОу, если у
– х 2 (правило Полинга)
Протолиз сильных кислот необратим
Анионы сильных кислот являются непротолитами и не участвуют в реакциях протолиза
H+
Слайд 45
HClO4 + CH3COOH ClO4–
+ CH3COOH2+
HNO3 + CH3COOH
NO3– + CH3COOH2+
Сила кислот в неводных растворителях
Уравнение реакции протолиза Сопряженная пара KК
HClO4/ ClO4–
1.10–6
HNO3/ NO3–
1.10–7
H+
H+
H+
H+
Слайд 46
Константа основности
A– + H2O
HA + ОН–
H+
H+
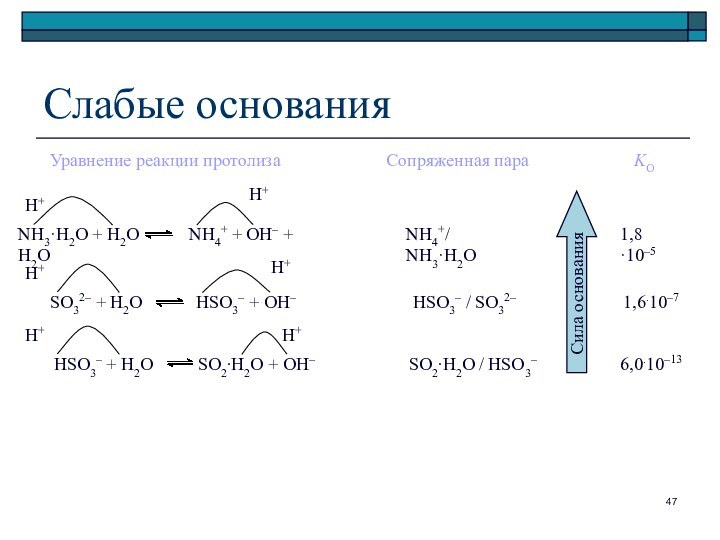
Слайд 47
HSO3– + H2O SO2∙H2O
+ OH–
SO32– + H2O
HSO3– + OH–
NH3·H2O + H2O NH4+ + OH– + H2O
Слабые основания
Уравнение реакции протолиза
Сопряженная пара
KО
NH4+/ NH3·H2O
1,8 ·10–5
HSO3– / SO32–
1,6.10–7
SO2∙H2O / HSO3–
6,0.10–13
H+
H+
H+
H+
H+
H+
Сила основания
Слайд 48
Сильные основания
Анионы:
амид-ион NH2–
метилат-ион CH3O– и другие алкоголят-ионы
гидроксид-ион
ОН–
Соединения, дающие эти ионы при диссоциации
MOH,
где М – щелочной элемент или Tl(I)
M(OH)2, где М – Ba, Ra
и др.
Катионы – непротолиты!
Слайд 49
Малорастворимые гидроксиды
Ni(OH)2(т) Ni2+
+ 2OH—
Слабое основание?
Сильное основание?
ПР = [Ni2+][OH—]2
Слайд 50
Связь Kк и Ko для пары НА/А–
[H3O+] [A–] [HA] [OH–]
KК KO = –––––––––––––––––––– = [H3O+] [OH–] = KB
[HA] [A–]
KO = KB / KК
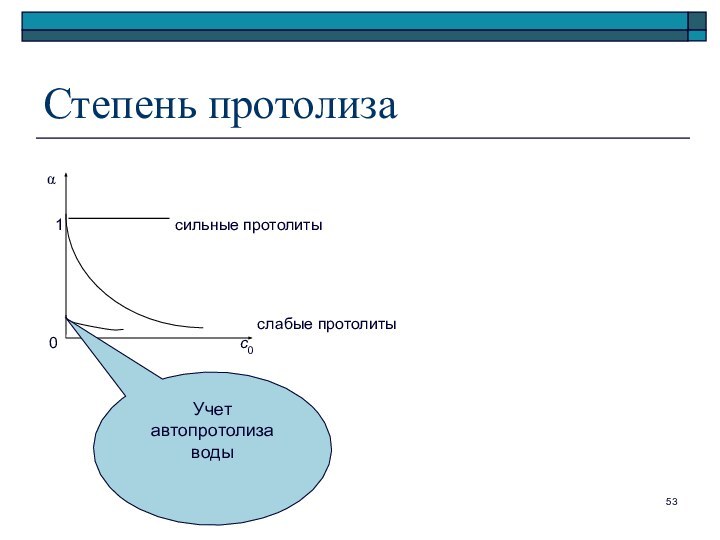
Слайд 51
Степень протолиза ()
– отношение числа частиц, подвергшихся
протолизу, к исходному числу частиц
Для реакции протолиза слабой
кислоты:
HA + H2O A– + H3O+
([H3O+] = [A–] при отсутствии в растворе других протолитов)
H+
H+
Слайд 52
Закон разбавления Оствальда
При
_____
= Kк / c0
Слайд 53
Степень протолиза
1
сильные протолиты
слабые протолиты
0 с0
Учет автопротолиза воды
Слайд 54
Учет автопротолиза воды
HA + H2O
A– + H3O+
H2O + H2O
OH– + H3O+
H+
H+
H+
H+
Слайд 55
Учет автопротолиза воды
Kкc0 – Kк[A–] = [A–][H3O+]
Слайд 56
Учет автопротолиза воды
При бесконечном разбавлении:
с0 → 0; [H3O+]
→ 10–7 моль/л
при Kк ≥ 10–5 α →
1
при Kк = 10–7 α → 0,5
Слайд 57
Сдвиг протолитических равновесий
Изменение концентрации слабого протолита
закон разбавления
Оствальда
разбавление
Изменение температуры
протолиз – эндотермический процесс
нагревание
Изменение концентрации одноименных ионов
принцип Ле Шателье
введение одноименных ионов
Слайд 58
Сдвиг протолитических равновесий
Протолиз слабой кислоты в присутствии сильной
кислоты:
HA + H2O A– + H3O+
= Kк / [H3O+]
H+
H+
Слайд 59
Определите рН в 0,001 М растворе серной кислоты.
H2SO4
+ 2H2O = SO42 + 2H3O+
с0(H2SO4) = 0,001 мольл
pH
= –lg [H3O+] = – lg(2c0) = – lg (2.10–3) = 2,7
2H+
Слайд 60
Определите рН в растворе азотной кислоты с концентрацией
с0 = 1.10–11 моль/л.
HNO3 + H2O = NO3– +
H3O+
[H3O+] = c0 = 1.10–11
pH = – lg[H3O+] = 11
H2O + H2O H3O+ + OH–
[H3O+] = 1.10–7
Ответ: рН 7
?
H+
Слайд 61
Определите рН в 0,002М растворе хлорноватистой кислоты при
25 °C.
HClO + H2O ClO– +
Н3O+; Kк = 2,82 . 10–8
[ClO–] = [H3O+]; [HClO] = c0
H+
H+
Слайд 62
Определите pH в 0,002М растворе аммиака при 25
°С.
KK = 5,75 . 10–10
KB = 1 . 10–14
[NH4+]
= [OH–]; [NH3 . H2O] = c0
NH3·H2O + H2O NH4+ + OH– + H2O
H+
H+
Слайд 63
Обратимый гидролиз солей
1. Диссоциация
2. Протолиз
Слайд 64
Гидролиз солей
KCl = K+ + Cl–
непротолиты
Нет
гидролиза, нейтральная среда, рН 7
NH4NO3 = NH4+ + NO3–
Кт непротолит
NH4+ + 2H2O NH3.H2O + H3O+
Гидролиз по катиону, кислотная среда, pH < 7
H+
H+
Слайд 65
Гидролиз солей
ZnSO4 = Zn2+ + SO42–
Zn2+.H2O + H2O
ZnOH+ + H3O+
Гидролиз по
катиону, кислотная среда, рН < 7
KNO2 = K+ + NO2–
NO2– + H2O HNO2 + OH–
Гидролиз по аниону, щелочная среда, pH > 7
H+
H+
H+
H+
Слайд 66
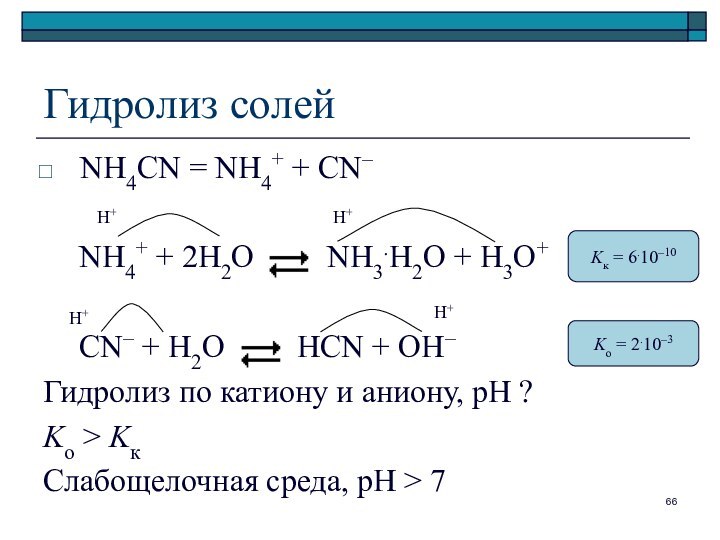
Гидролиз солей
NH4CN = NH4+ + CN–
NH4+ + 2H2O
NH3.H2O + H3O+
CN– + H2O
HCN + OH–
Гидролиз по катиону и аниону, рН ?
Ko > Kк
Слабощелочная среда, pH > 7
Kк = 6.10–10
Ko = 2.10–3
H+
H+
H+
H+
Слайд 67
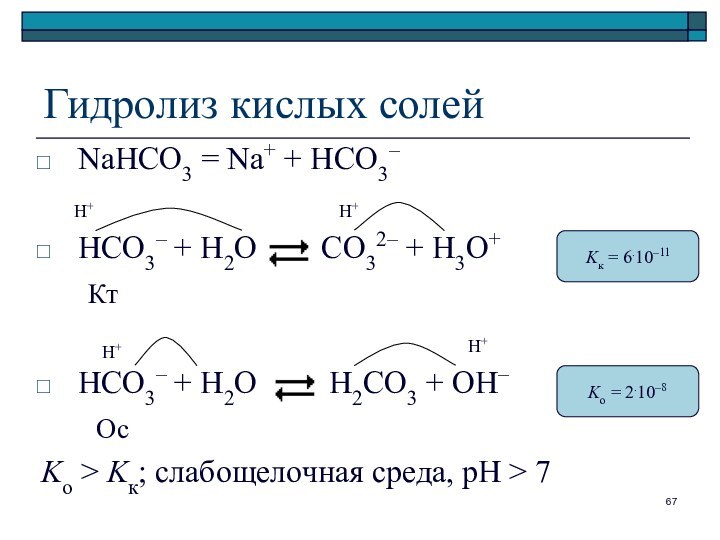
Гидролиз кислых солей
NaHCO3 = Na+ + HCO3–
HCO3– +
H2O CO32– + H3O+
Кт
HCO3– + H2O H2CO3 + OH–
Ос
Ko > Kк; слабощелочная среда, pH > 7
Kк = 6.10–11
Ko = 2.10–8
H+
H+
H+
H+
Слайд 68
Гидролиз солей
Усиление (α↑)
Повышение температуры
Понижение концентрации
Связывание одноименных ионов
Ослабление (α↓)
Понижение
температуры
Повышение концентрации
Введение одноименных ионов
Слайд 69
Необратимый гидролиз
PIIICl–I3(ж) + 3H2Oизб. = H2[PHO3](p) + 3HCl(p)
H2[PHO3]
+ H2O H[PHO3]– + H3O+
HCl +
H2O = Cl– + H3O+
pH < 7
H+
H+
H+
Слайд 70
Необратимый гидролиз
Mg3N + 8H2O = 2NH3.H2O + Mg(OH)2
NH3·H2O
+ H2O NH4+ +
OH– + H2O
Если Mg(OH)2 в осадке:
Mg(OH)2(т) Mg2+ + 2OH–
Если Mg(OH)2 в растворе:
Mg(OH)2 = Mg2+ + 2OH–
pH > 7
H+
H+
Слайд 71
Необратимый гидролиз
Al2S3(т) + 6H2O = 2Al(OH)3↓ + 3H2S↑
Совместный
гидролиз:
2Al3+ +3S2– + 6H2O = 2Al(OH)3↓ + 3H2S↑
Слайд 72
Определите рН 0,1 М раствора хлорида железа(III).
FeCl3
= Fe3+ + 3 Cl–
Fe3+.H2O + H2O
FeOH2+ + H3O+
[Fe(H2O)6]3+ + H2O [Fe(H2O)5(OH)]2+ + H3O+
[H3O+] [FeOH2+] [H3O+]2
Kк = –––––––––––––– = –––––––––– (если считать [Fe3+] = с0)
[Fe3+] с0
_____ ________
pH = – lg[H3O+] = –lgKк c0 = – lg7.10–3.10–1 = 1,6
H+
H+
H+
H+
Слайд 73
Определите рН 0,1 М раствора хлорида железа(III).
Более строгий
подход:
если считать [Fe3+] = с0(1 – α)
2с0
Kк = –––––––––
(1 – )
Слайд 74
Определите рН 0,1 М раствора хлорида железа(III).
При с0
= 0,1 моль /л и Kк = 7103 =
0,007:
0,007 = 2 0,1 {1 }
0,12 + 0,007 0,007 = 0
= 0,23; второй корень отрицательный
рH = lg[H3O+] = lgс0 = lg 0,23 0,1 = 1,6
Слайд 75
FeCl3 + H2O + Zn = ?
FeCl3 =
Fe3+ + 3 Cl–
Fe3+.H2O + H2O
FeOH2+ + H3O+
Zn + 2H3O+ = Zn2+ + H2 + 2H2O
H+
H+
Слайд 76
Определите рН в 0,1 М растворе ортофосфата натрия.
Na3PO4 = 3 Na+ + PO43–
PO43– + H2O
HPO42– + OH–
H+
H+
Слайд 77
Na3PO4 + H2O + Zn = ?
Na3PO4 (т)
= 3 Na+ + PO43–
PO43– + H2O
HPO42– + OH–
Zn + 2H2O + 2OH– = [Zn(OH)4]2– + H2
H+
H+
Слайд 78
Определите рН раствора, содержащего 0,001 моль/л уксусной кислоты
и 0,1 моль/л ацетата натрия.
CH3COONa = Na+ + CH3COO–
CH3COOH
+ H2O CH3COO– + Н3О+
[CH3COOH] = c0 – x
[CH3COO–] = c1 + x
c1
c0
x
H+
H+
Слайд 79
Определите рН раствора, содержащего 0,001 моль/л уксусной кислоты
и 0,1 моль/л ацетата натрия.
pH = – lg[H3O+] =
– lg x = –lg(Kкc0 /c1) =
= – lg 1,810–510–3/10–1 = 6,7
При разбавлении раствора рН не меняется!
Буферный раствор
Слайд 80
Определите pH в водном растворе NaHA
HA– – амфолит
(HCO3–, HS–, H2PO4–, HPO42– и т.д.)
Диссоциация:
NaHA = Na+
+ HA–
Протолиз иона-амфолита HA– как основания:
HA– + H2O H2A + OH–;
Kо(H2A/HA–) = Kв/Kк(H2A/HA–)
Протолиз иона-амфолита HA– как кислоты:
HA– + H2O A2– + H3O+;
Kк(HA–/A2–)
H+
H+
H+
H+
Слайд 81
Определите pH в водном растворе NaHA
Без вывода:
рН не
зависит от концентрации амфолита
Буферный раствор
Слайд 82
HA– pKк(H2A/HA–) pKк(HA–/A2–) pH
HCO3– 6,37 10,33 8,35
HSO3– 1,78 7,20 4,49
HS– 6,98 12,91 9,94
H2PO4– 2,14 7,21 4,68
HPO42– 7,21 12,34 9,78
Определите pH в
водном растворе NaHA
pK = –lgK












![Лекции по общей и неорганической химии Диаграмма растворимостиТсТплТкипГраница области метастабильныхпересыщенных растворов Область пересыщенных растворов c(B) > [B]Кривая растворимости](/img/tmb/14/1318463/f2754c31dbe8740de046d1841d8a9c04-720x.jpg)

![Лекции по общей и неорганической химии Сильные электролитыMA M+(р) + A–(р) [MA] = 0, [M+] = [A–] = c0Степень диссоциации:](/img/tmb/14/1318463/9b9b568e6c603350ff9a9cce3daf1e5d-720x.jpg)
![Лекции по общей и неорганической химии Слабые электролитыMA MA(р) + M+(р) + A–(р) [MA] > 0, [M+]](/img/tmb/14/1318463/8f197b0ea56afda23a293e04f08c878a-720x.jpg)



![Лекции по общей и неорганической химии Растворимость (L), моль/лМхАу(т) х Ма+ + у Аb–[Ma+] =](/img/tmb/14/1318463/cdad28a51cc328dee1eb1fb90ccd6ded-720x.jpg)











![Лекции по общей и неорганической химии Водородный показатель (рН) рН = –lg[H3O+][H3O+] = 10–рН Гидроксидный показатель (рОН)](/img/tmb/14/1318463/f94db93037a004e1cac677b4dbc9bbb8-720x.jpg)

![Лекции по общей и неорганической химии Шкала рНПри [H3O+] = 0,1 моль/л (например, в 0,1 М растворе HCl)](/img/tmb/14/1318463/6bb3b7a494c91a777aef6c49716c0816-720x.jpg)

![Лекции по общей и неорганической химии B(OH)3.H2O + H2O [B(OH)4]– + H3O+ Слабые](/img/tmb/14/1318463/d1b76f9ecaf26138718274749e04dafd-720x.jpg)




![Лекции по общей и неорганической химии Малорастворимые гидроксиды Ni(OH)2(т) Ni2+ + 2OH—Слабое основание?Сильное основание?ПР = [Ni2+][OH—]2](/img/tmb/14/1318463/f50fe0b21b51701e877d1df7f6554acc-720x.jpg)




![Лекции по общей и неорганической химии Учет автопротолиза водыKкc0 – Kк[A–] = [A–][H3O+]](/img/tmb/14/1318463/4645545134616af682902c5e044dcb67-720x.jpg)
![Лекции по общей и неорганической химии Учет автопротолиза водыПри бесконечном разбавлении:с0 → 0; [H3O+] → 10–7 моль/лпри Kк](/img/tmb/14/1318463/442174923d40a517afcfb252ea4d31e3-720x.jpg)










 + 3HCl(p)H2[PHO3] + H2O](/img/tmb/14/1318463/716b7f7dcaad64ff726c4fdb58a4541c-720x.jpg)



![Лекции по общей и неорганической химии Определите рН 0,1 М раствора хлорида железа(III).Более строгий подход:если считать [Fe3+] =](/img/tmb/14/1318463/452f652fe073b2b40e92d56d852e09d9-720x.jpg)