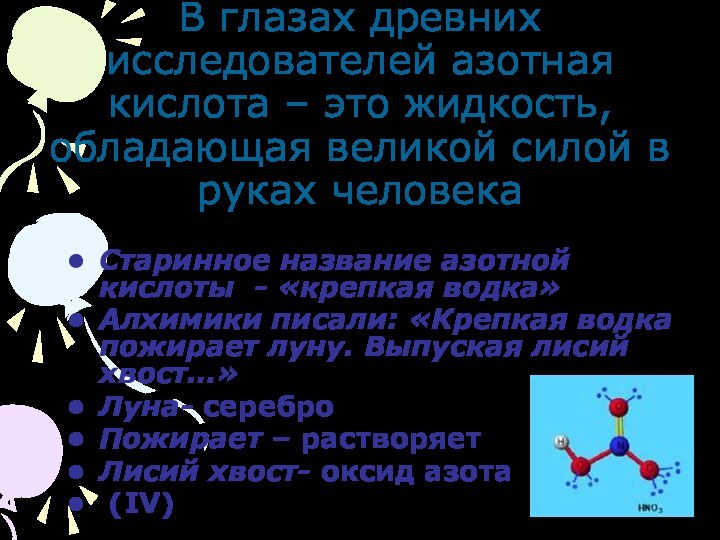
«Кислородные соединения азота»
Повторить свойства азотной кислоты
Закрепить особенности взаимодействия
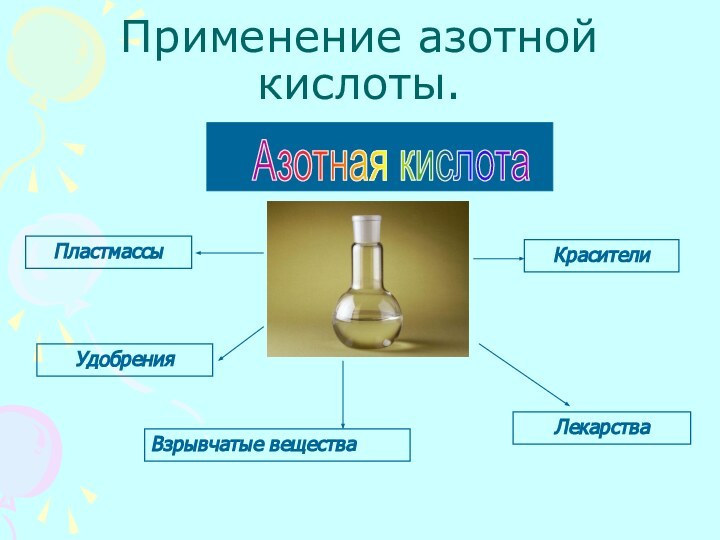
азотной кислоты с металлами и неметалламиРассмотреть получение и применение азотной кислоты