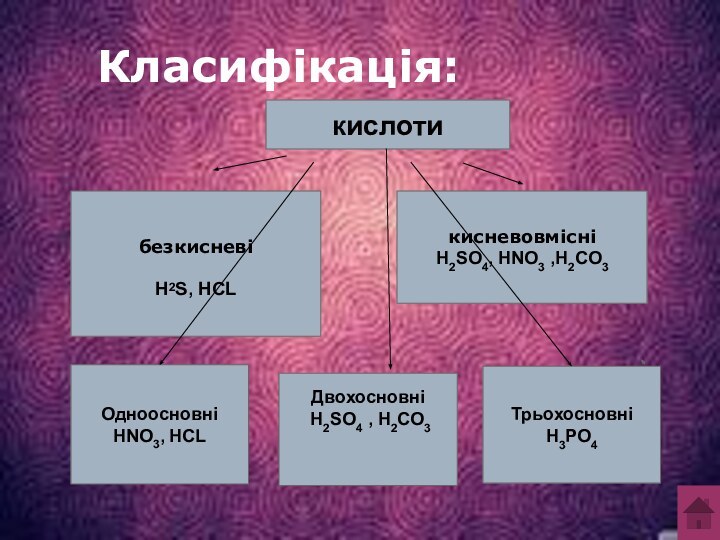
розчиненні в йонізуючому розчиннику (воді), дисоціюють з утворенням йонів
водню (або протону, Н+), таким чином знижуючи кислотність розчину до величини менше ніж pH 7,0.HCL = H++CL-
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть













HCL = H++CL-
Фізичні властивості:
Способи добування:
Кислоти в їжі:
Кислоти в рослинному світі:
Кислоти в тваринному світі: