- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему: Окислительно-восстановительные реакции (8 класс)
Содержание
- 2. Степень окисленияэто условный заряд атомов химического элемента
- 3. +
- 4. Окислительно-восстановительные реакциихимические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов
- 5. Восстановлениеэто процесс присоединения электронов атомами, ионами или
- 6. Окислениепроцесс отдачи электронов атомами, ионами или молекулами.
- 7. Процесс окисления
- 8. HNO3 + Cu → Cu(NO3)2 + NO
- 9. HNO3 + Cu → Cu(NO3)2 + NO + H2O
- 10. Если химический элемент в составе вещества проявляет
- 11. САМОСТОЯТЕЛЬНОВыполнение заданий №1, 5 – 7 (а,
- 12. ПРОВЕРКА№1А) не ОВРВ) не ОВР
- 13. ПРОВЕРКА№1
- 14. ПРОВЕРКА№5H2S – S-2 – проявляет восстановительные свойстваH2SO4 – S+6 – проявляет окислительные свойства
- 15. ПРОВЕРКА№6SO2 может быть и окислителем и восстановителем,
- 16. ПРОВЕРКА№7
- 17. ПРОВЕРКА№8 с. 204 (Рабочая тетрадь)
- 18. ДОМАШНЕЕ ЗАДАНИЕпараграф 44, выполнить задания №7 (в, г), 8 после параграфа 44
- 19. Скачать презентацию
- 20. Похожие презентации
Степень окисленияэто условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентные полярные) состоят только из ионов.








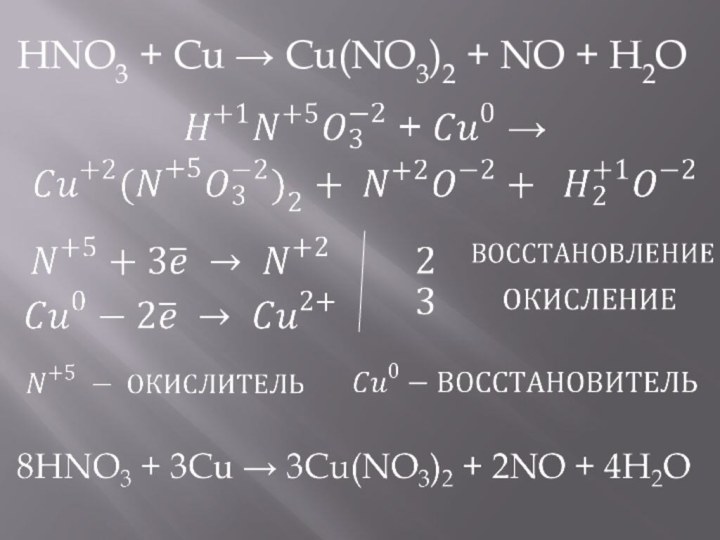










Слайд 3 + -
+
+5 -2 + - + +5 -2H Cl + Ag N O3 = Ag Cl + H N O3
2H Cl + Mg = Mg Cl2 + H2
+ - 0 +2 - 0
Степени окисления изменяются
Степени окисления не изменяются
Н+ → Н02
Mg0 → Mg2+
Слайд 4
Окислительно-восстановительные реакции
химические реакции, в результате которых происходит изменение
степеней окисления атомов химических элементов
Слайд 5
Восстановление
это процесс присоединения электронов атомами, ионами или молекулами.
Степень окисления при этом понижается. Атомы, ионы или молекулы,
принимающие электроны называются окислителями.
Слайд 6
Окисление
процесс отдачи электронов атомами, ионами или молекулами. Степень
окисления при этом повышается. Атомы, ионы или молекулы, отдающие
электроны, называются восстановителями.
Слайд 7
Процесс окисления
Процесс восстановления
восстановитель
окислительОкисление всегда сопровождается восстановлением.