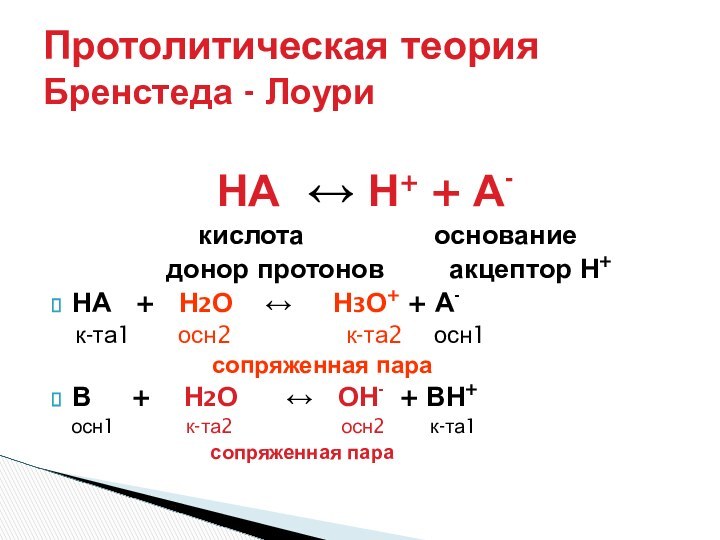
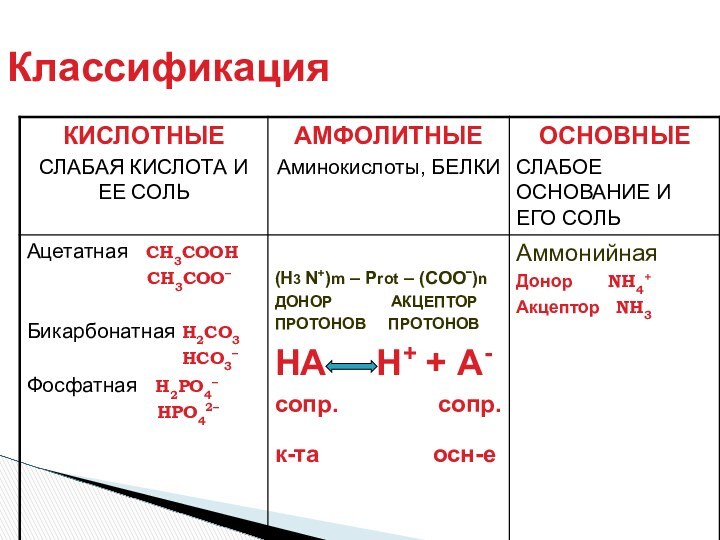
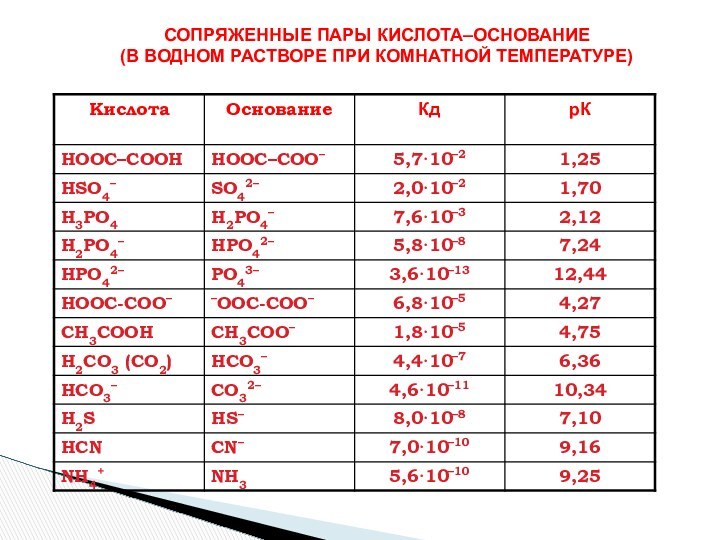
- Лоури (кислота – донор протона, основание – акцептор
протона)Теория Г. Льюиса (кислота -акцептор пары электронов, основание донор пары электронов).
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть


![Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3) [H+] = [OH-] = 10-7 моль/л рН = 7 нейтральная среда[H+] ‹](/img/tmb/15/1462621/41792e78fedaaaa3adf5a61c68346281-720x.jpg)
![Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3) Кислотность раствора - [H+] рН = - lg C Сильные кислоты](/img/tmb/15/1462621/e97ee26862c757ed7c87c2da81968733-720x.jpg)










![Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3) [НСО3–]:[СО2] = 20:1](/img/tmb/15/1462621/c25f4fd64a14ee73e88c410d90e0ab55-720x.jpg)
![Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3) [НСО3–] Щелочной резерв крови Число мл СО2, содержащееся в 100 мл](/img/tmb/15/1462621/2638c1f41f91b2a1c85a652cc47cc55c-720x.jpg)







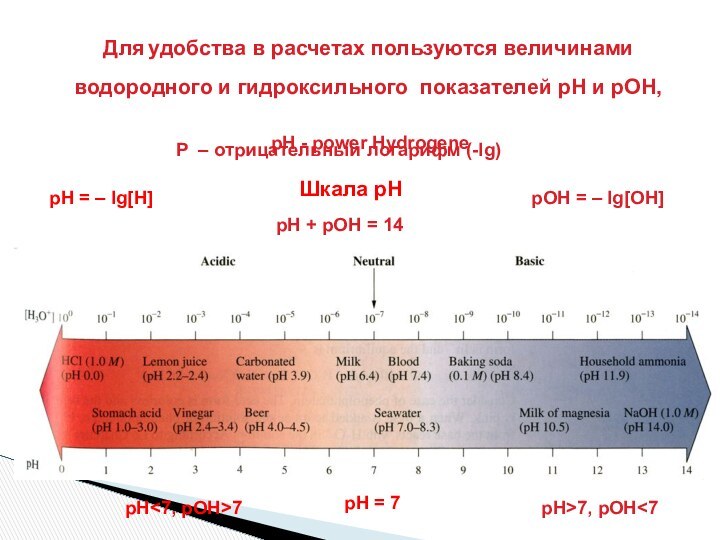
рН = 7
рН<7, рОН>7
рН>7, рОН<7
рН + рОН = 14
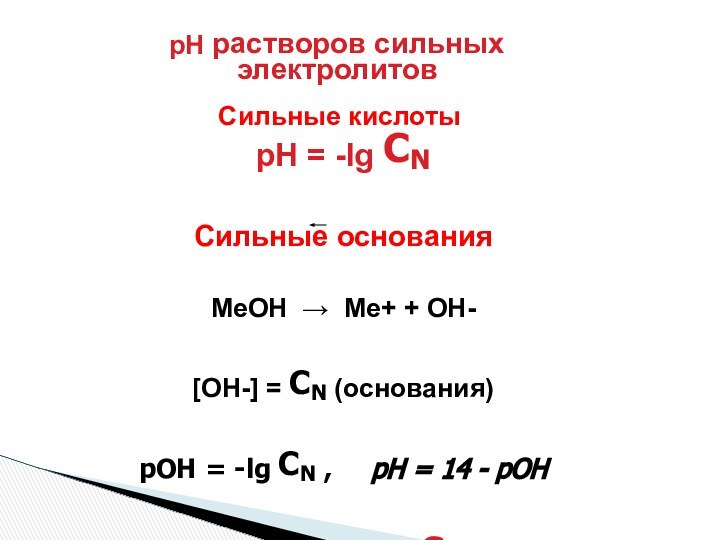
рН = – lg[H]
Шкала рН
рОН = – lg[OH]
Р – отрицательный логарифм (-lg)
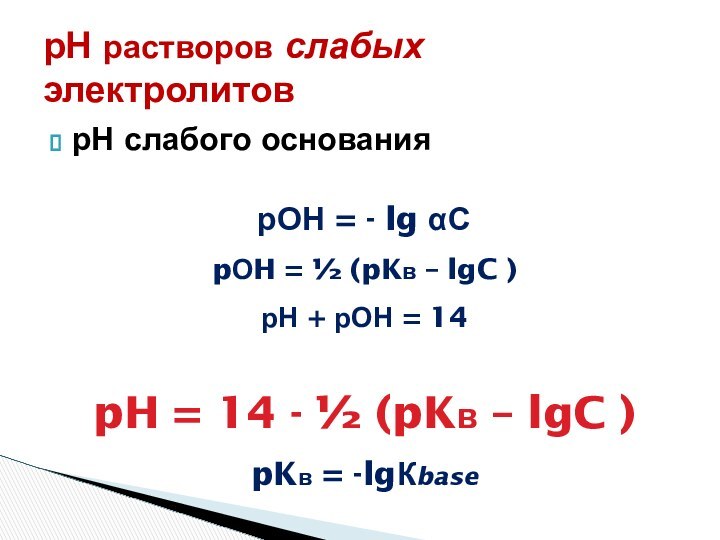
рН = - lg αС
Слабые кислоты
С – αС → αС
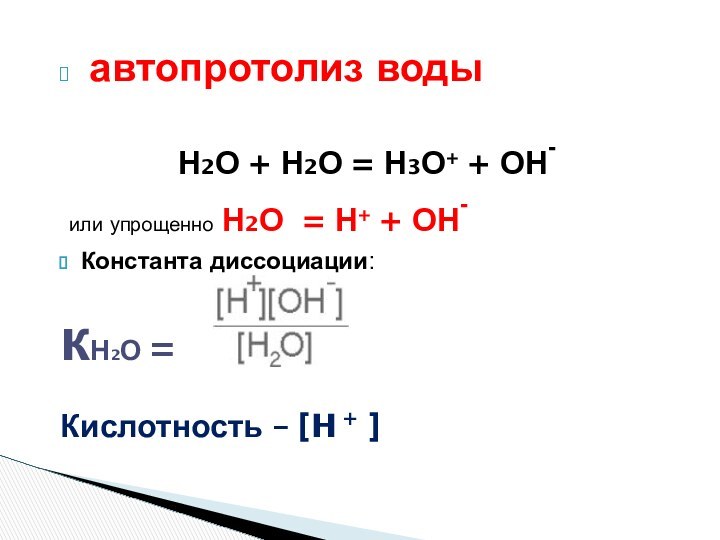
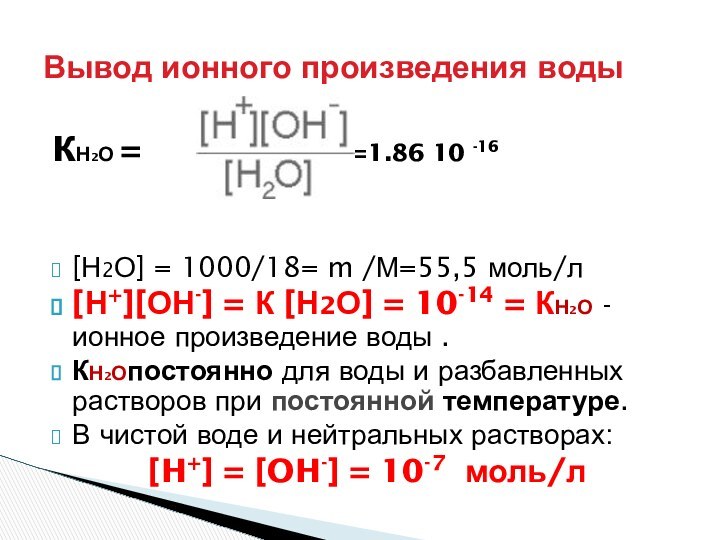
Кислотность:
Общая – С
Активная – αС= [H+]
Потенциальная - С – αС
Почему важно поддержание постоянного рН ?
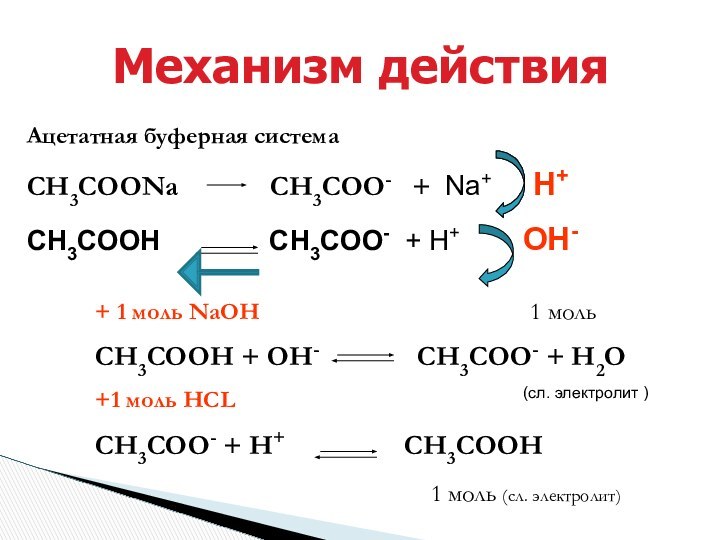
+ 1 моль NaOH 1 моль
СН3СООН + ОН- СН3СОО- + Н2О
+1 моль HCL (сл. электролит )
СН3СОО- + Н+ СН3СООН
1 моль (сл. электролит)
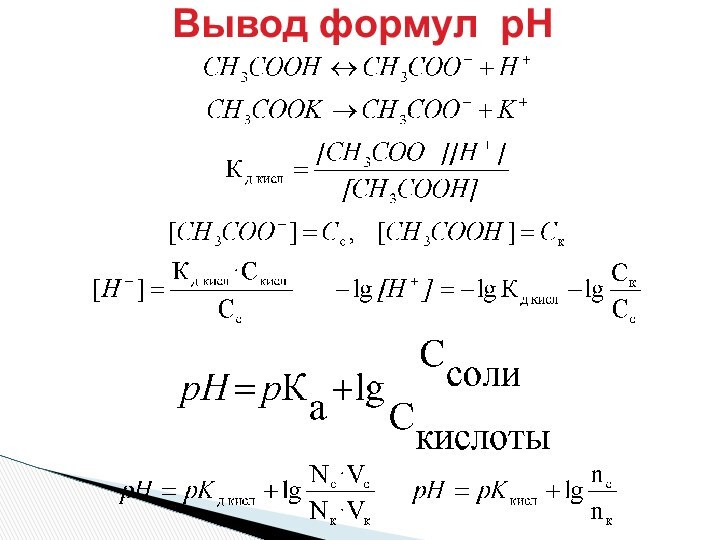
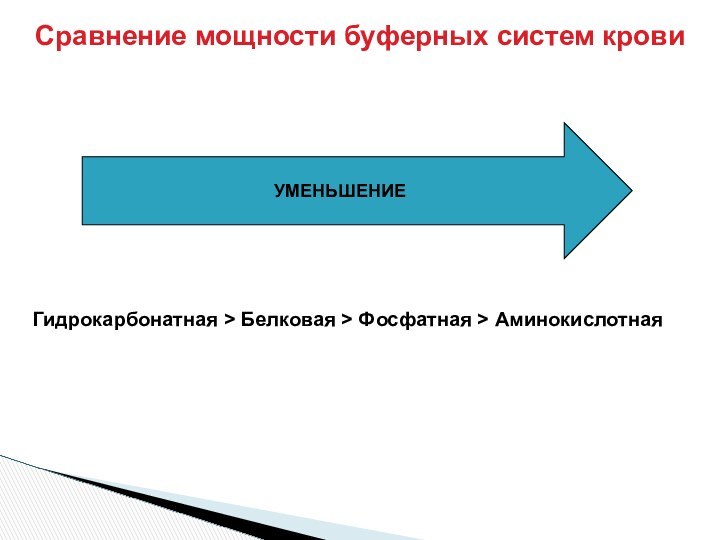
От соотношения количеств
50 экв соли \50 экв к-ты = 1
+ 10 экв NaOH:
60/ 40 = 1.5
80 экв соли 20 экв к-ты = 4
+ 10 экв NaOH: 90 /10 = 9
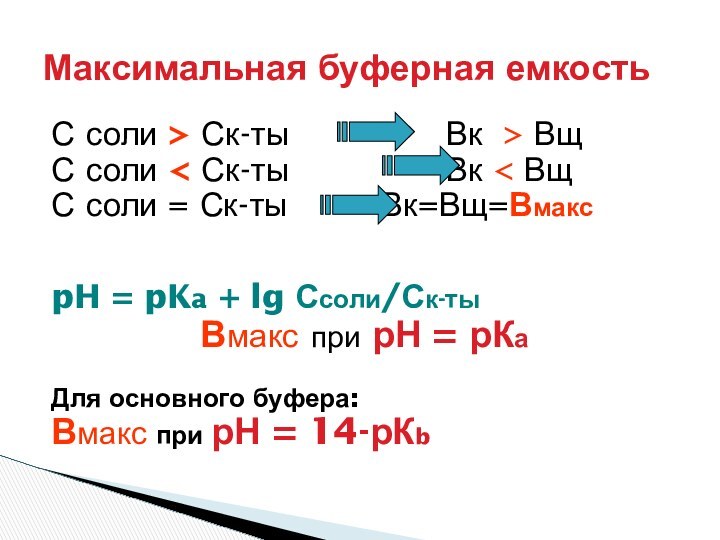
pH = pKa + lg Ссоли/Ск-ты
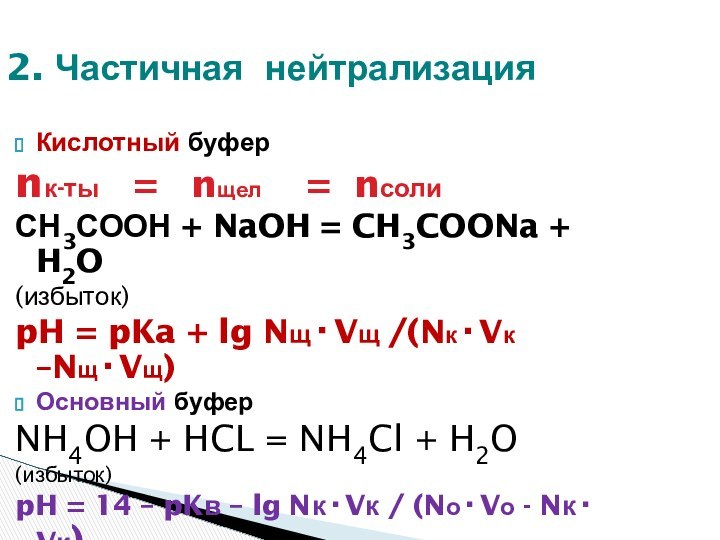
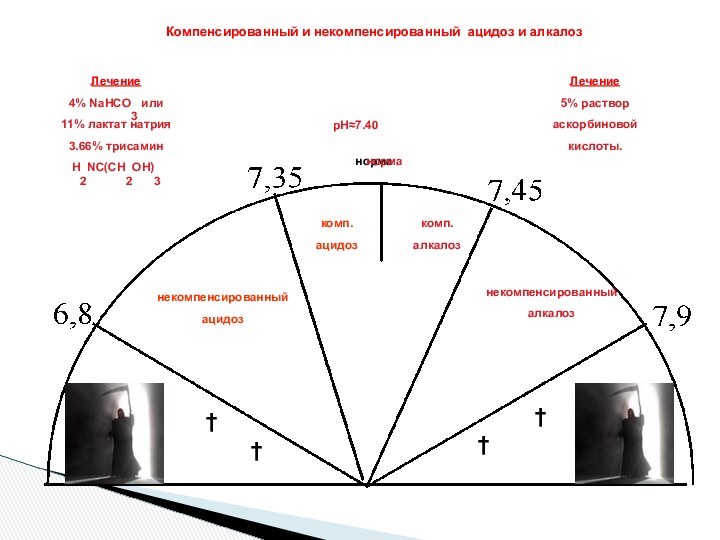
ЗОНА БУФЕРНОГО ДЕЙСТВИЯ СИСТЕМЫ:
рН = рК +- 1
Максимальная буферная емкость
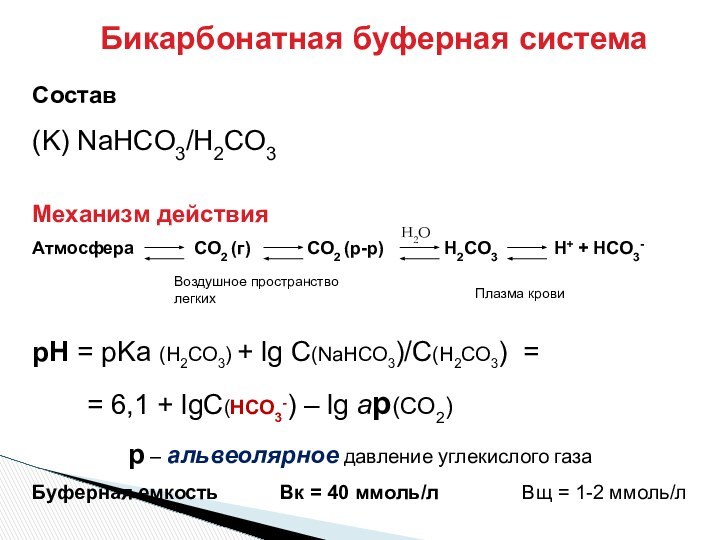
Воздушное пространство легких
Плазма крови
H2O
рН крови
Норма:
50-70 % (по объему)
или 25-30 ммоль/л
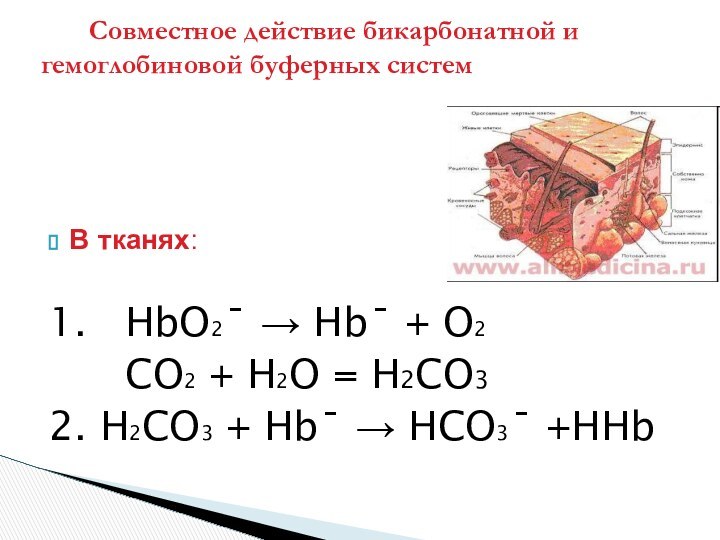
Более сильная угольная кислота вытесняет более слабую
гемоглобиновую, пополняя щелочной резерв крови
( концентрацию гидрокарбоната )
Механизм кооперативного действия гемоглобиновой и
бикарбонатной буферных систем тесно связан с дыхательной
функцией крови
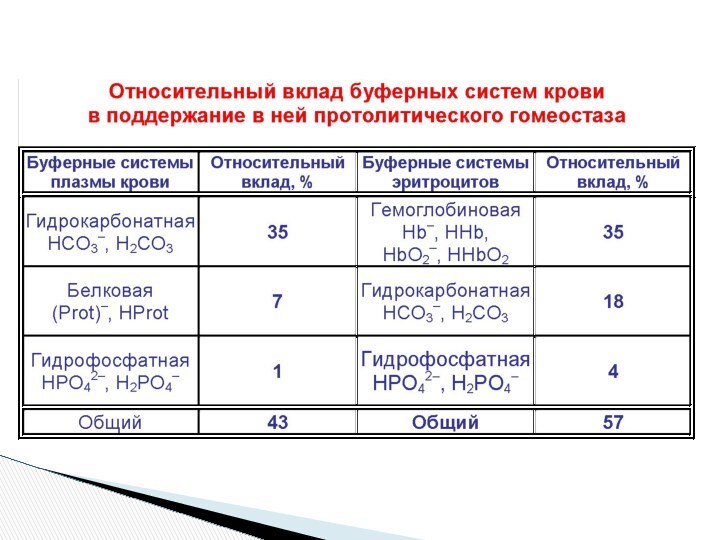
Совместное действие бикарбонатной и гемоглобиновой буферных систем
Совместное действие бикарбонатной и гемоглобиновой буферных систем