- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Кислоты
Содержание
- 2. Что такое кислоты?Слова "кислота" и "кислый" не
- 3. Что такое кислоты?Кислота – это сложное вещество,
- 4. Классификация кислотКлассификация кислот по составу.
- 5. Классификация кислотПо содержанию кислорода бескислородные (HCl, H2S);кислородосодержащие
- 6. Классификация кислот.По количеству атомов водорода, способных замещаться
- 7. Химические свойства кислотВзаимодействие с оксидами металлов с
- 8. Химические свойстваВзаимодействие с солями, если выпадает осадок или выделяется газ:
- 9. Кислоты в нашей жизниАзотная кислота широко используется
- 10. Скачать презентацию
- 11. Похожие презентации
Что такое кислоты?Слова "кислота" и "кислый" не зря имеют общий корень. Растворы всех кислот на вкус кислые. Это не означает, что раствор любой кислоты можно пробовать на язык – среди них встречаются очень едкие и даже








Слайд 3
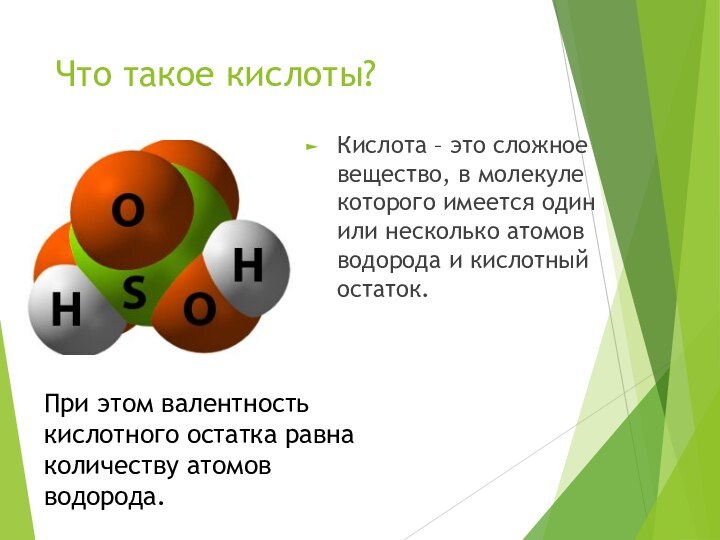
Что такое кислоты?
Кислота – это сложное вещество, в
молекуле которого имеется один или несколько атомов водорода и
кислотный остаток.При этом валентность кислотного остатка равна количеству атомов водорода.
Слайд 5
Классификация кислот
По содержанию кислорода
бескислородные (HCl, H2S);
кислородосодержащие (HNO3).
По
основности — количество кислых атомов водорода
Одноосновные (HPO3);
Двухосновные (H2SeO4, Азелаиновая
кислота);Трёхосновные (H3PO4).
Четырёхосновные (H4СO4).
Слайд 6
Классификация кислот
.
По количеству атомов водорода, способных замещаться на
металл, все кислоты делятся на одноосновные (с одним атомом
водорода), двухосновные (с 2 атомами Н) и трехосновные (с 3 атомами Н)** Термин "одноосновная кислота" возник потому, что для нейтрализации одной молекулы такой кислоты требуется "одно основание", т.е. одна молекула какого-либо простейшего основания типа NaOH или KOH:
HNO3 + NaOH = NaNO3 + H2O
HCl + KOH = KCl + H2O
Двухосновная кислота требует для своей нейтрализации уже "два основания", а трехосновная – "три основания":
H2SO4 + 2 NaOH = Na2SO4 + 2 H2O
H3PO4 + 3 NaOH = Na3PO4 + 3 H2O
Слайд 7
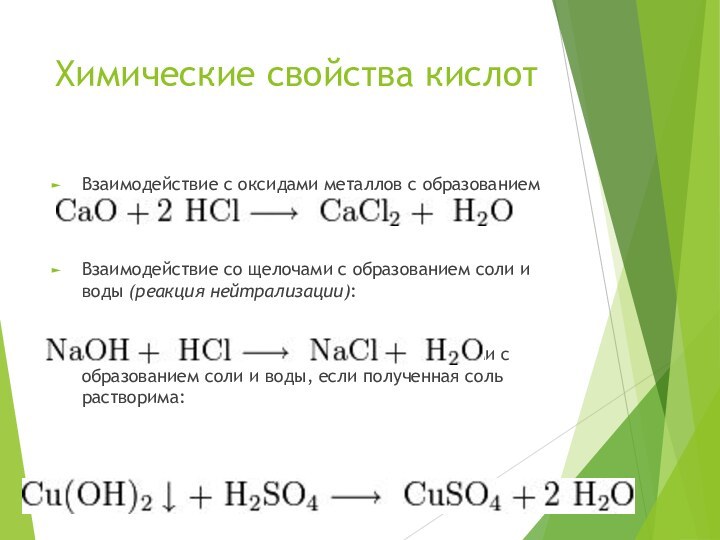
Химические свойства кислот
Взаимодействие с оксидами металлов с образованием
соли и воды:
Взаимодействие со щелочами с образованием соли и
воды (реакция нейтрализации):Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если полученная соль растворима: