Слайд 2
Цели урока:
Дать представления о галогенах на основании их
сравнительной характеристики;
Рассмотреть простые вещества – галогены, их физические и
химические свойства;
Продолжить формирование умения сравнивать свойства простых веществ.
Слайд 3
Проверка домашнего задания:
тестирование
выписать номера свойств и характеристик для
(1 варианта) металлов, для (2 варианта) неметаллов:
Маленький радиус атомов
Большой
радиус атомов
На внешнем уровне от 1 до 3 электронов
На внешнем уровне от 4 до 8 электронов
Ковкость
Металлический блеск
Газообразное агрегатное состояние
Пластичность
Различная окраска
Плохая электропроводность
Твердое агрегатное состояние
Хорошая теплопроводность
Хорошая электропроводность
Ярко выраженные восстановительные свойства
Ярко выраженные окислительные свойства
Аллотропия
Слайд 4
Правильные ответы:
для металлов характерно:
Маленький радиус атомов
Большой радиус атомов
На
внешнем уровне от 1 до 3 электронов
На внешнем уровне
от 4 до 8 электронов
Ковкость
Металлический блеск
Газообразное агрегатное состояние
Пластичность
Различная окраска
Плохая электропроводность
Твердое агрегатное состояние
Хорошая теплопроводность
Хорошая электропроводность
Ярко выраженные восстановительные свойства
Ярко выраженные окислительные свойства
Аллотропия
Слайд 5
Правильные ответы:
для неметаллов характерно:
Маленький радиус атомов
Большой радиус атомов
На
внешнем уровне от 1 до 3 электронов
На внешнем уровне
от 4 до 8 электронов
Ковкость
Металлический блеск
Газообразное агрегатное состояние
Пластичность
Различная окраска
Плохая электропроводность
Твердое агрегатное состояние
Хорошая теплопроводность
Хорошая электропроводность
Ярко выраженные восстановительные свойства
Ярко выраженные окислительные свойства
Аллотропия
Слайд 6
Цепочка превращений:
Н2 → NaH → Н2 →
HCl
NaOH
H2 + 2Na = 2NaH
NaH + HCl = NaCl + H2↑
H2 + Cl2 = 2HCl
NaH + H2O = NaOH + H2↑
2NaOH + 2Al + 6H2O = 2Na[Al(OH)4] +3H2↑
Слайд 7
Задача №2 стр. 93
Дано:
Решение:
V( возд.)=100 л V(O2)= V( возд.)* ᵠ (O2)= 100*0,21=
ᵠ (O2)=21% 21 л.
ᵠ (N2) =78% n (O2)= V/ Vm = 21л / 22,4 л/моль =
0,94 моль
n (O2)=? V(N2) = 100*0,78 = 78 л
n (N2) =? n (N2)=78л / 22,4л/моль = 3,48моль
Ответ: 0,94 моль, 3,48 моль.
Слайд 8
Задача №3 стр.103
Дано:
Решение:
mтех.(WO3) =928 кг W(WO3) = 100%-25%=75%
W(примес.) = 25% m (WO3) = mтех. * W (WO3) =
V(H2)=? 928кг * 0,75 = 696 кг
n(W)=? n(WO3)=m/M=696кг/232кг/кмоль=
= 3 кмоль
WO3 + 3Н2 = W + 3Н2О
1 моль 3моль 1моль
3 кмоль 9 кмоль 3 кмоль
V(H2)= nVm = 9 кмоль * 22,4 м3/кмоль = 201,6 м3
Ответ: 201,6 м3, 3 кмоль.
Слайд 9
Изучение нового материала:
Положение в ПСХЭ и строение атомов:
VII группа главная подгруппа
Слайд 10
Общая характеристика галогенов:
на внешнем уровне 7 электронов;
увеличивается радиус
атомов;
ослабевают неметаллические свойства;
окислительная способность уменьшается.
Фтор – самый сильный
окислитель (с.о.-1)
У остальных: с.о. -1, +1, +3, +5, +7
Слайд 11
Галогены – простые вещества
Фтор F2 –
ядовитый газ
светло-
желтого цвета с
резким
раздражающим
запахом.
Слайд 18
Простые вещества -галогены
2. Хлор Cl2 –
желто-зеленый газ
с
резким
удушливым
запахом
Слайд 24
Простые вещества - галогены
3. Бром Br2 –
жидкость
бурого
цвета со
зловонным
запахом
Слайд 28
Простые вещества - галогены
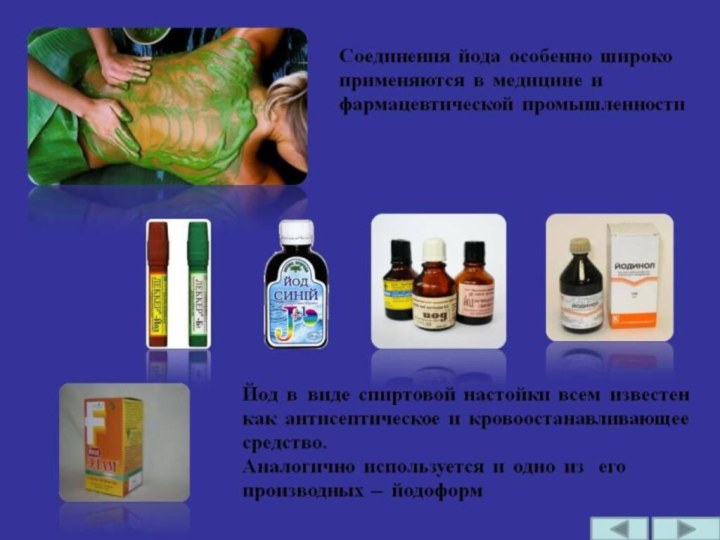
4. Йод I2 –
твердое
вещество
черно-серого цвета
с металлическим
блеском и
резким запахом
Слайд 35
Химические свойства галогенов
Взаимодействие с простыми веществами:
а) с водородом
Н2
Н2 + Г2 = 2НГ
б) с металлами
F2 при нагревании реагирует даже с Au, Ag и Pt
Слайд 37
Химические свойства галогенов
2. Взаимодействие со сложными веществами:
а) с
водой
2F2 + 2H2O = 4HF + O2
б)
с галогенидами металлов
Cl2 → Br2 → I2
окислительная способность уменьшается