2. Дегидроциклизация (ароматизация алканов):
3. Получение бензола тримеризацией ацетилена.4. Сплавление солей ароматических кислот со щелочью:
Способы получения.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть













Способы получения.
Химические свойства
В зависимости от строения радикала в галогеналкане можно получить разные гомологи бензола:
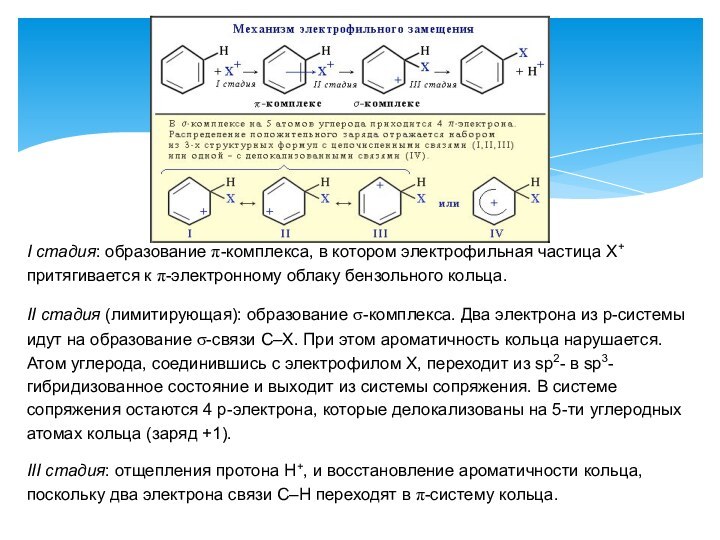
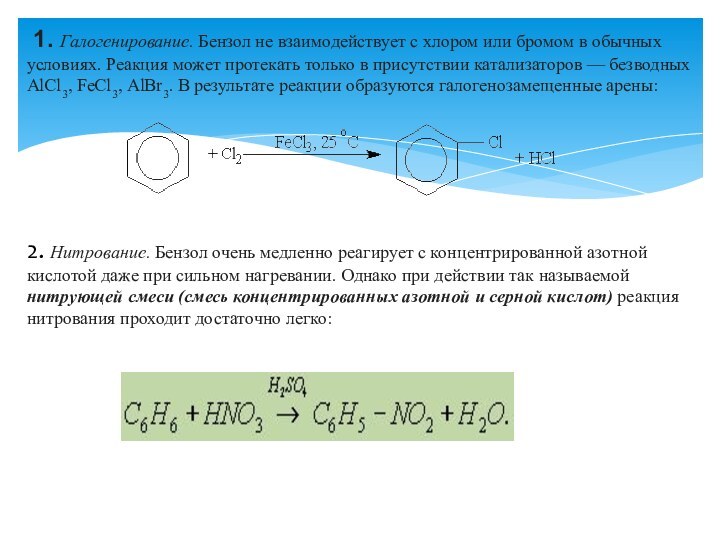
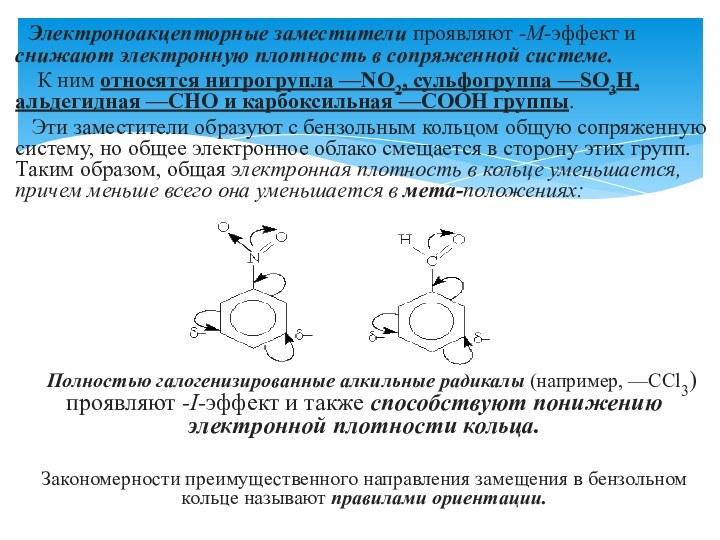
Правила ориентации (замещения) в бензольном кольце.
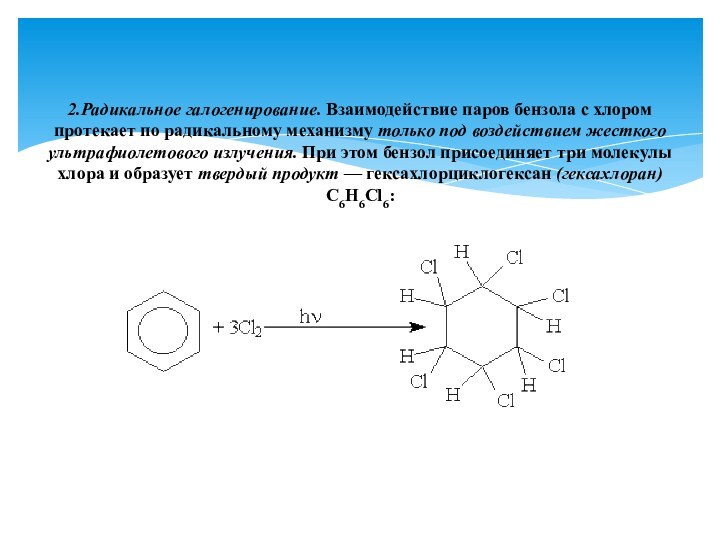
Реакции присоединения к аренам приводят к разрушению ароматической системы и требуют больших затрат энергии, поэтому протекают только в жестких условиях.
Реакции по алкильному заместителю