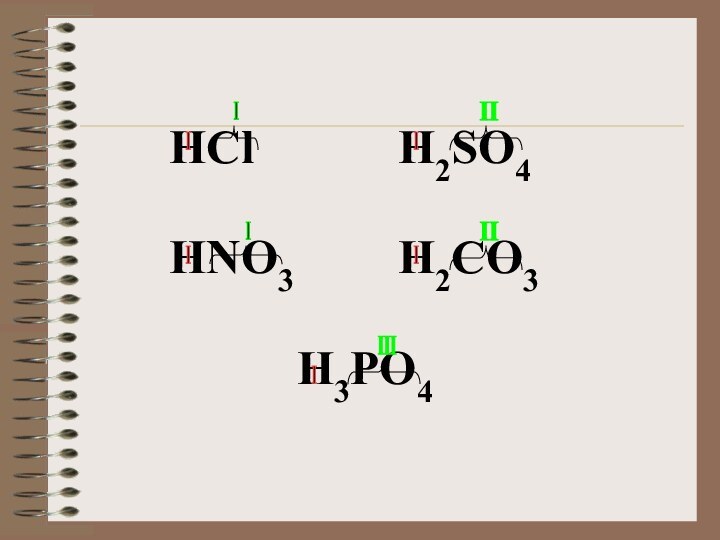
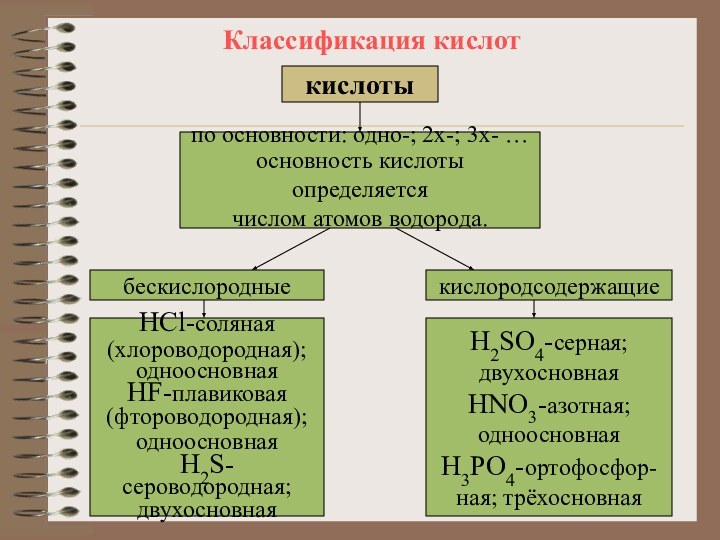
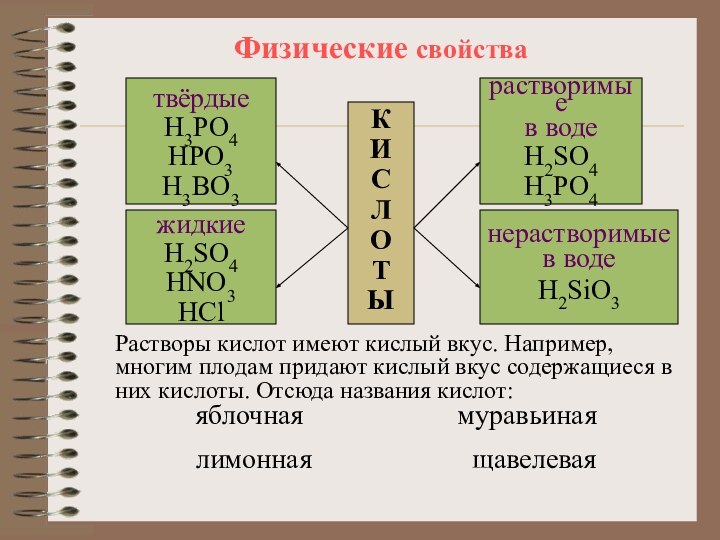
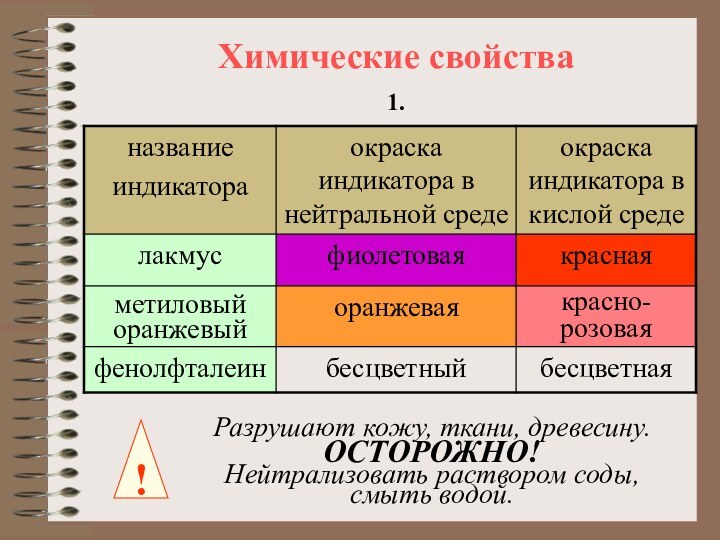
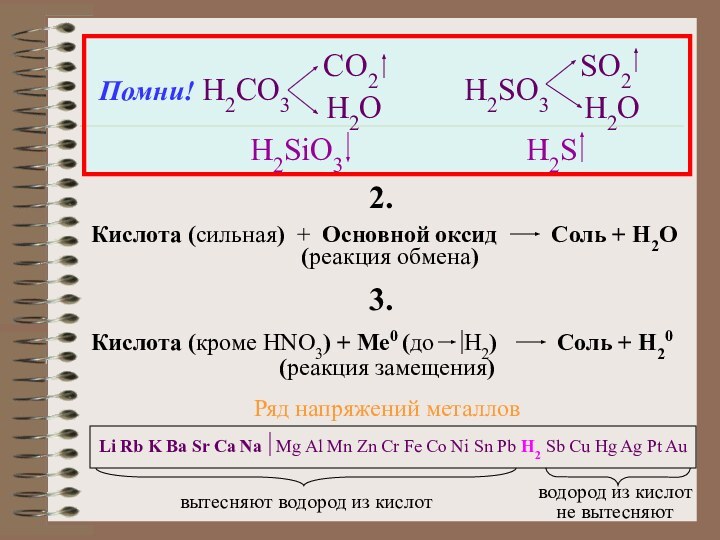
содержат один или несколько атомов водорода, способных замещаться на
атомы металла, и кислотного остатка.Общая формула кислот: Hx(Ac), где Ас- кислотный остаток (от англ. аcid- кислота); x- число атомов водорода, равное валентности кислотного остатка.