- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Классы неорганических соединений
Содержание
- 2. Оксиды Образованы двумя химическими элементами Один из элементов кислород, имеющий степень окисления -2Примеры: MgO, H2O
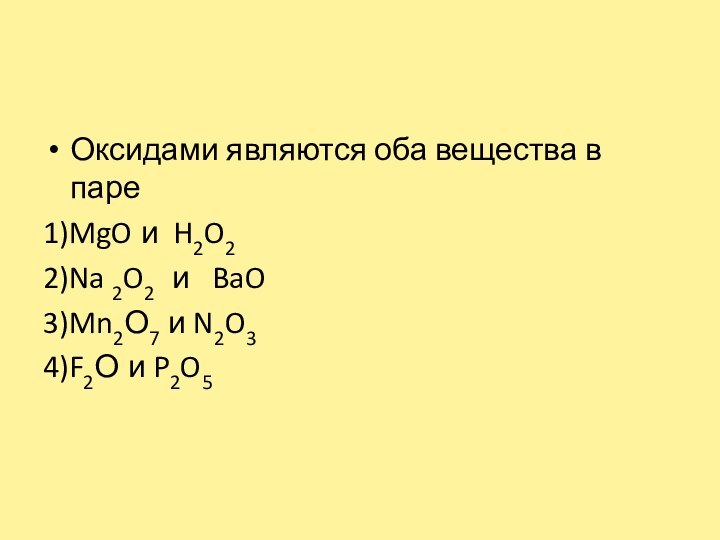
- 3. Оксидами являются оба вещества в паре1)MgO и
- 4. Классификация оксидовНесолеобразующие (безразличные)NOCON2OСолеобразующиеОсновныеКислотныеАмфотерные
- 5. Основные оксидыОксиды металлов, в которых металл имеет
- 6. Свойства основных оксидов Реагируют с кислотами:
- 7. Кислотные оксиды Оксиды неметаллов и металлов, в
- 8. Свойства кислотных оксидов Реагируют со щелочами (растворимыми
- 9. Амфотерные оксиды Оксиды металлов, в которых металл
- 10. Свойства амфотерных оксидов Амфотерность – двойственность свойствРеагируют
- 11. С водой реагируют оксиды: 1)BaO и SiO22)СuO и SO33)BaO и SO34)FeO и СО2
- 12. Оксид серы (IV) взаимодействует с каждым из
- 13. С соляной кислотой реагируют каждый из двух
- 14. И с раствором гидроксида натрия и с
- 15. Гидроксиды Основные – основания (щелочи и нерастворимые в воде) Кислотные – кислоты кислородсодержащие Амфотерные
- 16. Только кислоты расположены в ряду1)HNO3, Ca(NO3)2, NO22)KHCO3, Ba(HSO4)2, Zn(OH)Cl3)HNO2, HNO3, CH3COONa4)H2S, Н2SO3, CH3COOH
- 17. Оцените правильность следующих суждений:А) Гидроксиды по свойствам
- 18. Щелочи – растворимые в воде основанияЩелочи образуют
- 19. Свойства щелочейРеагируют с кислотами: 2NaOH + H2SO4
- 20. Нерастворимые в воде основанияРеагируют с кислотами: Mg(OH)2 + 2HNO3 = Mg(NO3)2 +2H2OРазлагаются при нагревании: Mg(OH)2 = MgO +H2O
- 21. Кислотные гидроксиды – кислородсодержащие кислотыРеагируют с основаниями: KOH
- 22. Амфотерные гидроксидыРеагируют с кислотами, проявляя свойства оснований: Al(OH)3
- 23. Гидроксид натрия не взаимодействует с 1)CuCl22)SO23)PbS4)HNO3
- 24. Гидроксид натрия реагирует со всеми веществами ряда:1)Zn,
- 25. Гидроксид калия реагирует со всеми веществами группы1)Zn, SiO2, H2O2)HNO3, Na2CO3, Mg3)CuSO4, SO3, H3PO44)CuO, Cа(OH)2, N2O5
- 26. В ряду превращений: CuO→CuCl2→Cu(OH)2
- 27. В ряду превращений NaOH→Na 2CO3→CO2
- 28. Каждое из перечисленных веществ: CuCl2, SO3, H3PO4,
- 29. При действии избытка раствора гидроксида натрия на
- 30. Скачать презентацию
- 31. Похожие презентации
Оксиды Образованы двумя химическими элементами Один из элементов кислород, имеющий степень окисления -2Примеры: MgO, H2O





























Слайд 2
Оксиды
Образованы двумя химическими элементами
Один из элементов
кислород, имеющий степень окисления -2
Слайд 4
Классификация оксидов
Несолеобразующие (безразличные)
NO
CO
N2O
Солеобразующие
Основные
Кислотные
Амфотерные
Слайд 5
Основные оксиды
Оксиды металлов, в которых металл имеет степень
окисления +1 или +2 как правило
Основным оксидам соответствуют основания
(основные гидроксиды):Na2O – NaOH
MgO – Mg(OH)2
Слайд 6
Свойства основных оксидов
Реагируют с кислотами:
MgO + H2SO4 = MgSO4 + H2O
Некоторые
реагируют с водой (оксиды щелочных и щелочно-земельных металлов):Na2O + H2O = 2NaOH
Реагируют с кислотными оксидами:
CaO + CO2 = CaCO3
Слайд 7
Кислотные оксиды
Оксиды неметаллов и металлов, в которых
элемент имеет степень окисления +4 и выше как правило
Кислотным оксидам соответствуют кислоты (кислотные гидроксиды):CO2 – H2CO3 Mn2O7 – HMnO4
SO3 – H2SO4 CrO3 – H2CrO4, H2Cr2O7
Слайд 8
Свойства кислотных оксидов
Реагируют со щелочами (растворимыми в
воде основаниями):
CO2 + 2NaOH = Na2CO3 + H2O
Большинство реагирует
с водой:SO3 + H2O = H2SO4
Реагируют с основными оксидами:
P2O5 + 3CaO = Ca3(PO4)2
Слайд 9
Амфотерные оксиды
Оксиды металлов, в которых металл проявляет
степень окисления +3 или +4 как правило
Амфотерным оксидам
соответствуют амфотерные гидроксиды:Al2O3 – Al(OH)3 ZnO – Zn(OH)2
Cr2O3 – Cr(OH)3 BeO – Be(OH)2
MnO2 – Mn(OH)4
Слайд 10
Свойства амфотерных оксидов
Амфотерность – двойственность свойств
Реагируют с
кислотами, проявляя свойства основных оксидов:
Al2O3 + 6HCl = 2AlCl3
+ 3H2OРеагируют со щелочами, проявляя свойства кислотных оксидов:
Al2O3 + 2NaOH + 3H2O= 2Na[Al(OH)4]
Al2O3 + 2NaOH = 2NaAlO2 + H2O (при сплавлении)
Слайд 12
Оксид серы (IV) взаимодействует с каждым из двух
веществ:
1)H2O и KCl
2)Ba(OH)2 и CaO
3)CaCO3 и ZnSO3
4)Ca(OH)2 и
N2
Слайд 13
С соляной кислотой реагируют каждый из двух оксидов
1)K2O
и SO3
2)Al2O3 и CaO
3)CO2 и ZnO
4)CrO3 и Na2O
Слайд 14
И с раствором гидроксида натрия и с серной
кислотой реагирует
1)ВаO
2) Cr2O3
3) SiO2
4) MgO
Слайд 15
Гидроксиды
Основные – основания (щелочи и нерастворимые в воде)
Кислотные
– кислоты кислородсодержащие
Амфотерные
Слайд 16
Только кислоты расположены в ряду
1)HNO3, Ca(NO3)2, NO2
2)KHCO3, Ba(HSO4)2,
Zn(OH)Cl
3)HNO2, HNO3, CH3COONa
4)H2S, Н2SO3, CH3COOH
Слайд 17
Оцените правильность следующих суждений:
А) Гидроксиды по свойствам делятся
на кислоты, основания и амфотерные гидроксиды.
Б) Гидроксиды
элементов главных подгрупп первой и второй групп Периодической системы – растворимые основания (щелочи).1)верно только А
2)верно только Б
3)верны оба суждения
4)оба суждения неверны
Слайд 18
Щелочи – растворимые в воде основания
Щелочи образуют металлы
1 группы главной подгруппы (щелочные металлы) и щелочноземельные металлы
(Ca, Sr, Ba)Примеры: NaOH, Ca(OH)2
Слайд 19
Свойства щелочей
Реагируют с кислотами:
2NaOH + H2SO4 =
Na2SO4 + 2H2O
Реагируют с кислотными оксидами:
2NaOH + CO2 =
Na2CO3 + H2OРеагируют с растворами солей, если выпадает осадок:
2NaOH+ CuSO4 = Cu(OH)2↓ + Na2SO4
Реагируют с металлами, образующими амфотерные оксиды и гидроксиды:
2NaOH + Zn +2H2O = Na2[Zn(OH)4] + Н2
Слайд 20
Нерастворимые в воде основания
Реагируют с кислотами:
Mg(OH)2 + 2HNO3
= Mg(NO3)2 +2H2O
Разлагаются при нагревании:
Mg(OH)2 = MgO +H2O
Слайд 21
Кислотные гидроксиды – кислородсодержащие кислоты
Реагируют с основаниями:
KOH +
HNO3 = KNO3 + H2O
Реагируют с основными оксидами:
MgO +
H2SO4 = MgSO4 + H2OРеагируют с металлами, стоящими в ряду напряжений до водорода:
Mg + H2SO4 = MgSO4 + H2
Реагируют с солями:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2
Слайд 22
Амфотерные гидроксиды
Реагируют с кислотами, проявляя свойства оснований:
Al(OH)3 +
3HCl = AlCl3 + 3H2O
Реагируют со щелочами, проявляя свойства
кислот:Al(OH)3 + NaOH = Na[Al(OH)4]
Слайд 24
Гидроксид натрия реагирует со всеми веществами ряда:
1)Zn, Na
2CO3, CuO
2)CO2, H3 PO4 CuO
3)S O3, H3PO 4, AI2O3
4)SO3,
MgO, H3PO4,
Слайд 25
Гидроксид калия реагирует со всеми веществами группы
1)Zn, SiO2,
H2O
2)HNO3, Na2CO3, Mg
3)CuSO4, SO3, H3PO4
4)CuO, Cа(OH)2, N2O5
Слайд 26
В ряду превращений:
CuO→CuCl2→Cu(OH)2 вещества
X и Y соответственно
1)НСl и NaOH
2)HCl и
Fe(OH)33)NaCl и Н2O
4)Cl2 и H2O
Слайд 27
В ряду превращений
NaOH→Na 2CO3→CO2
веществa X и Y соответственно
1)Н2CO3
и NaOH2)CaCO3 и NaOH
3)CO2 и H2O
4)CO2 и H2 SO4
Слайд 28
Каждое из перечисленных веществ: CuCl2, SO3, H3PO4, Zn(OH)2
реагирует
с
1)серной кислотой
2)водой 3)гидроксидом натрия 4)оксидом углерода(VI)
Слайд 29
При действии избытка раствора гидроксида натрия на раствор
сульфата цинка образуется
1) ZnO
2) Zn(OH)2
3) Na2ZnO2
4)Na2[Zn(OH)4]





























