- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Урок по теме: Неметаллы (5 вар)
Содержание
- 2. Положение неметаллов в Периодической системе МенделееваСамо слово
- 3. Окислительные свойства металловДля атомов металлов характерны сравнительно
- 4. Свойства неметалловНеметаллы – простые вещества, при обычных
- 5. Если для подавляющего большинства металлов характерен серебристо-белый
- 6. Температуры плавления неметаллов также лежат в очень
- 7. Например, элемент фосфор образует простое вещество с
- 8. В отличие от бесцветного кислорода O2, не
- 9. В природе озон образуется при электрических зарядах
- 10. Озон – гораздо более сильный окислитель, чем
- 12. Воздух, свободный от переменных и случайных составных
- 13. Воздух – это океан из газов, на
- 14. Скачать презентацию
- 15. Похожие презентации
Положение неметаллов в Периодической системе МенделееваСамо слово «неметаллы» указывает, что свойства элементов-неметаллов и соответствующих им простых веществ противоположны свойствам металлов. Из известных химических элементов только 22 являются неметаллами. Элементы с типично неметаллическими свойствами расположены по диагонали













Слайд 3
Окислительные свойства металлов
Для атомов металлов характерны сравнительно большие
радиусы и небольшое число электронов на внешнем уровне (1–3).
Атомам неметаллов, наоборот, свойственны небольшие радиусы атомов и число электронов на внешнем энергетическом уровне от 4 до 8 (у бора этих электронов 3, но атомы этого элемента имеют маленький радиус).
Отсюда и стремление атомов металлов к отдаче внешних электронов т.е. восстановительные свойства, а для атомов неметаллов – стремление к приему недостающих до заветной восьмерки электронов, т.е. окислительные свойства
Слайд 4
Свойства неметаллов
Неметаллы – простые вещества, при обычных условиях
могут быть газами, жидкостями и твердыми веществами.
Свойства простых веществ,
образуемых неметаллами, отличаются большим разнообразием. Хотя по сравнению с металлами неметаллов гораздо меньше, для них трудно выделить общие характерные признаки. Судите сами: водород, кислород и озон, фтор, хлор, азот – газы при обычных условиях, бром – жидкость, а бор, углерод (алмаз и графит), кремний, фосфор (красный и белый), сера (пластическая и ромбическая), селен, телур, иод, астат – твердые вещества. Слайд 5 Если для подавляющего большинства металлов характерен серебристо-белый цвет,
то окраска неметаллов – простых веществ охватывает все цвета
спектра: красный (красный фосфор, красно-бурый жидкий бром), желтый (сера), зеленый (хлор – желто-зеленый газ), фиолетовый (пары йода).Красный фосфор
Слайд 6 Температуры плавления неметаллов также лежат в очень широком
интервале: от 3800 oC до у графита до -210
oC у азота. Эта особенность неметаллов является следствия образования ими двух типов кристаллических решеток: молекулярной (O2, O3, N2, галогены, белый фосфор и др.) и атомной (алмаз, графит, кремний, бор и др.). Разным строением кристаллических решеток объясняется и явление аллотропии (способность атомов одного химического элемента образовывать несколько простых веществ).Слайд 7 Например, элемент фосфор образует простое вещество с молекулярной
кристаллической решеткой – белый фосфор, молекулы которого имеют состав
P4, и простое вещество с атомной кристаллической решеткой – красный фосфор P.Вторая причина аллотропии связана с разным числом атомов в молекулах простых веществ. Типичный пример – простые вещества, образуемые кислородом: кислород O2 и озон O3.
Слайд 8
В отличие от бесцветного кислорода O2, не имеющего
запаха, озон – это светло-синий газ с сильным запахом.
Примесь озона в воздухе, появляющаяся после грозы, дает ощущение приятной свежести; содержится озон и воздухе сосновых лесов и морского побережья.
Слайд 9
В природе озон образуется при электрических зарядах или
окислении органических смолистых веществ, а также при действии ультрафиолетовых
лучей на кислород. В лаборатории его получают в специальных приборах – озонаторах при действии на кислород тихим (без искр) электрическим зарядом.
Слайд 10
Озон – гораздо более сильный окислитель, чем кислород.
На сильной окислительной способности озона основано его применение: отбеливание
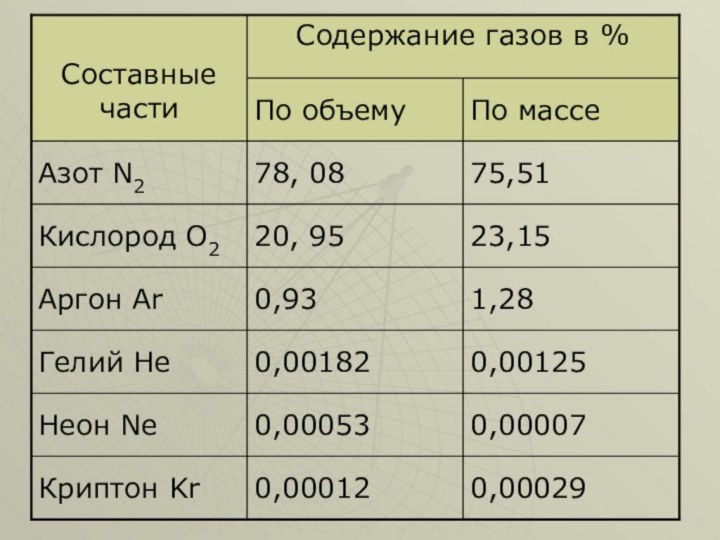
тканей, дезодорирование жиров и масел, обеззараживание воздуха и питьевой воды.Озон имеет огромное значение для всего живого на Земле. Его относят к переменным составляющим воздуха. Постоянные составляющие воздуха – азот, кислород, благородные газы (аргон, гелий, неон и т.п.) Воздух также может содержать постоянные и случайные компоненты.
Слайд 12
Воздух, свободный от переменных и случайных составных частей,
прозрачен, лишен цвета, вкуса и запаха, 1 л его
при н.у. имеет массу 1,29 г. Молярный объем (22,4 л) воздуха весит 29 г.
Слайд 13
Воздух – это океан из газов, на дне
которого живут люди, животные и растения. Он необходим для
дыхания и фотосинтеза. Растворенный в воде кислород воздуха служит для дыхания обитателей водной среды.Велика роль воздуха в процессах выветривания горных пород и для почвообразования. Под действием воздуха и бактерий минерализуются органические остатки – отжившие органические вещества превращаются в минеральные соединения и снова усваиваются растениями.