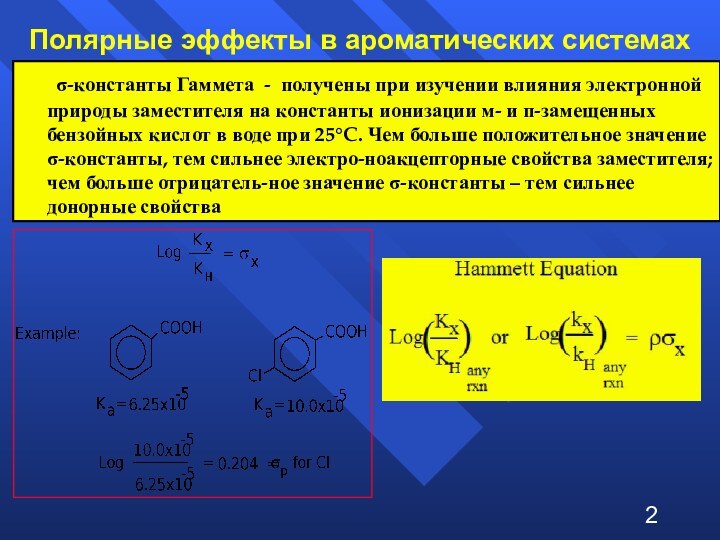
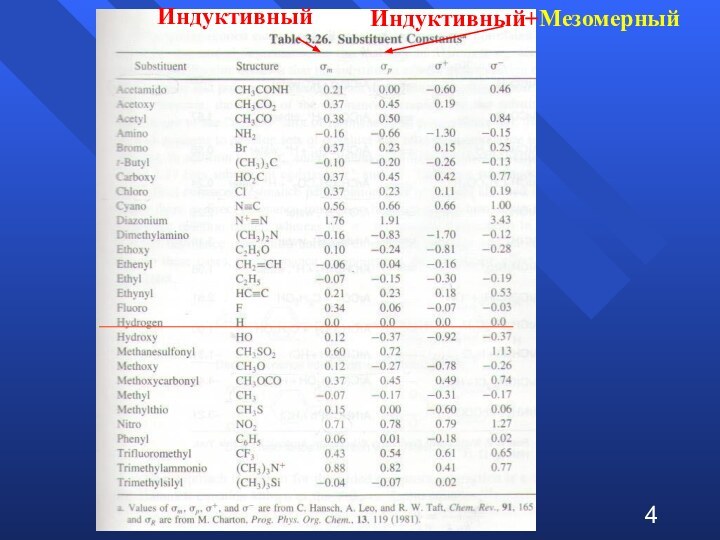
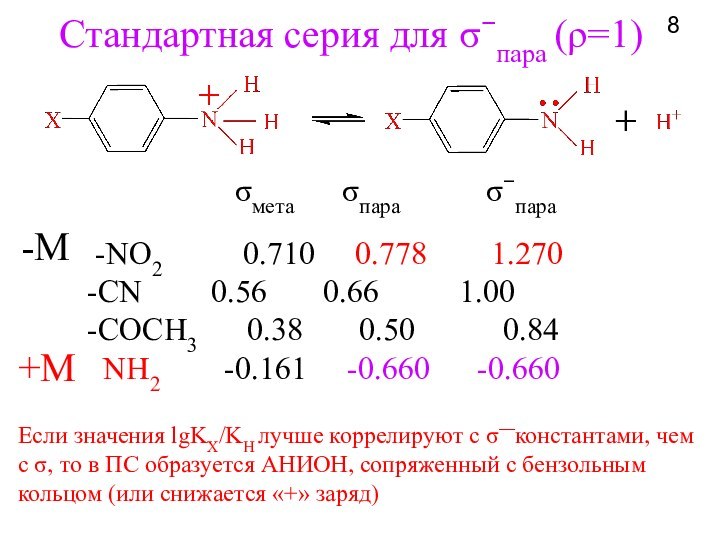
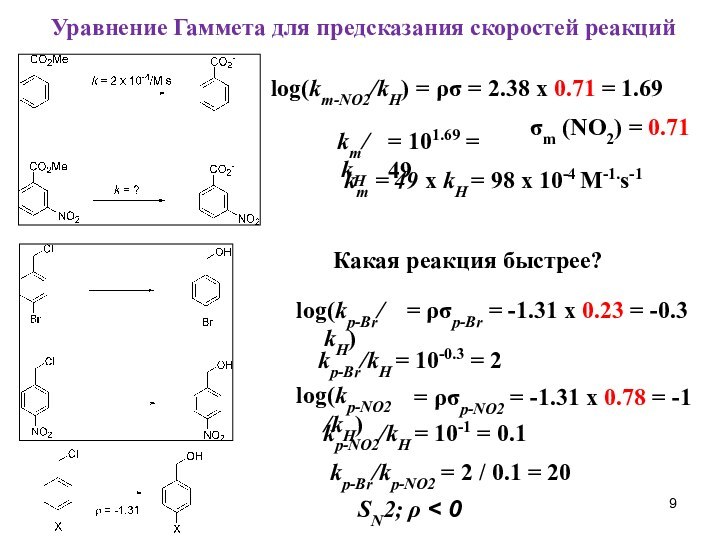
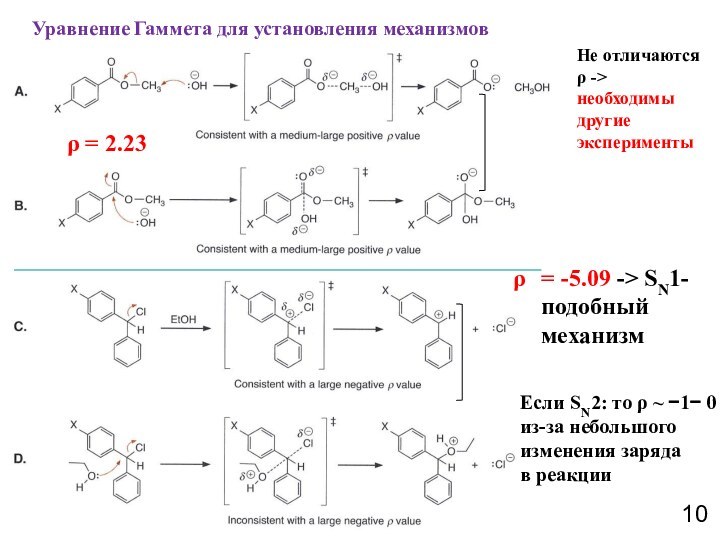
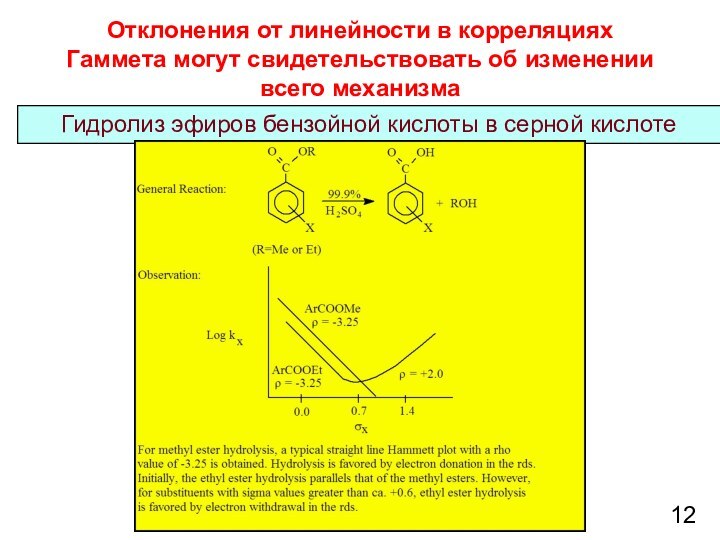
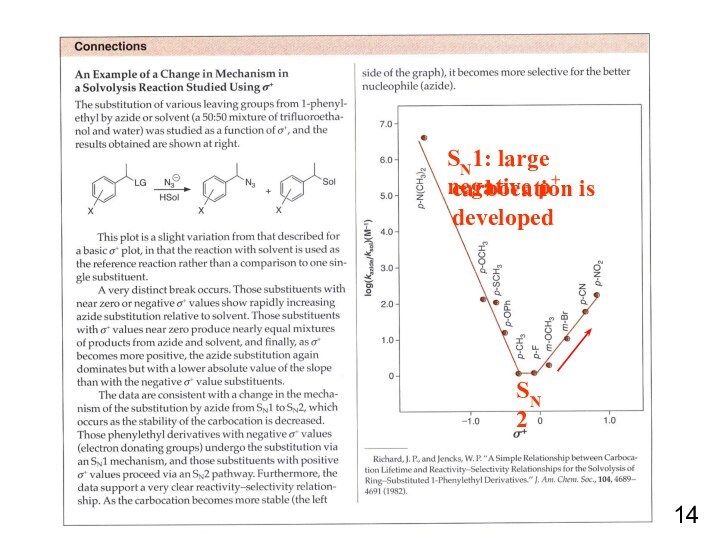
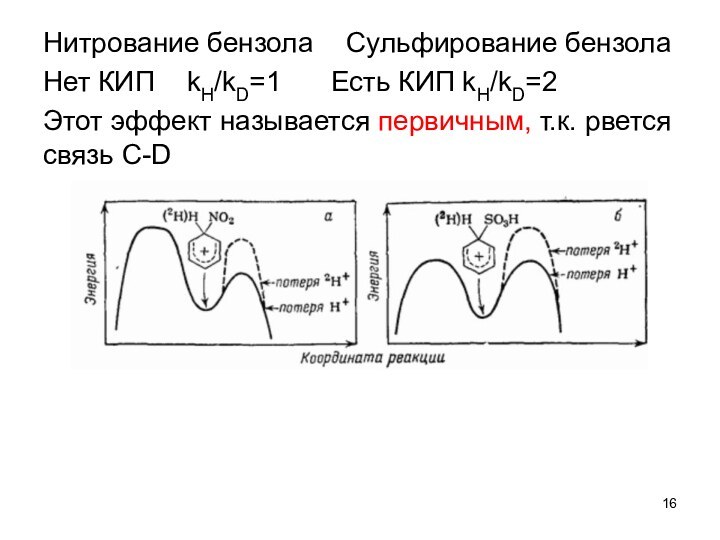
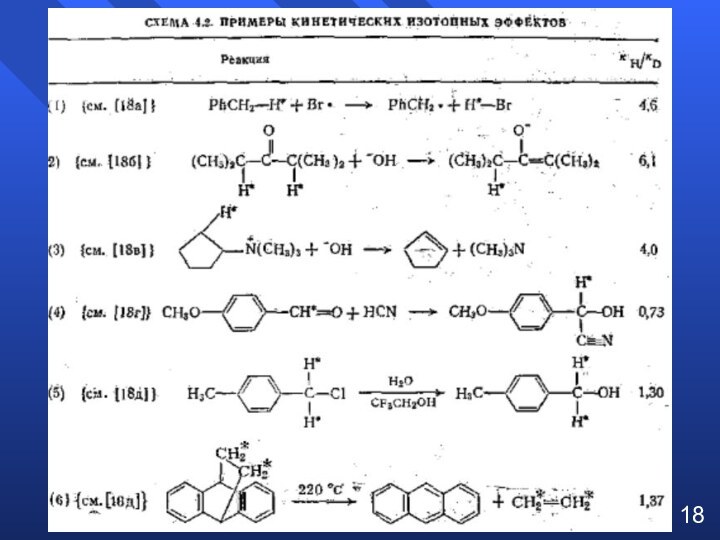
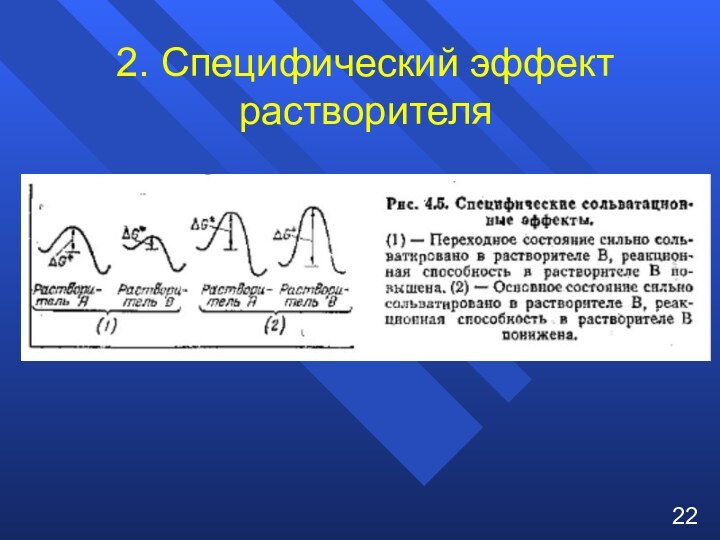
при изучении влияния электронной природы заместителя на константы ионизации
м- и п-замещенных бензойных кислот в воде при 25°C. Чем больше положительное значение σ-константы, тем сильнее электро-ноакцепторные свойства заместителя; чем больше отрицатель-ное значение σ-константы – тем сильнее донорные свойства2