Слайд 2
Задачи урока
Продолжить формирование понятий: количество вещества, моль, молярная
масса, молярный объем, число Авогадро;
Выявить их взаимосвязь, пользоваться ими
при решении экспериментальных задач;
Закрепить навыки решения задач по данной теме.
Слайд 3
Эпиграф
«О, физика, наука из наук!
Все впереди!
Как мало за
плечами!
Пусть химия нам будет вместо рук.
Пусть станет математика очами.
Не
разлучайте этих трех сестер
Познания всего в подлунном мире,
Тогда лишь будет ум и глаз остер
И знанье человеческое шире»
(отрывок из поэмы М. Алигер «Ленинские горы»)
Слайд 4
Экспресс - опрос
Что такое количество вещества?
Что такое моль?
Сколько
структурных единиц содержится в 1 моле?
Через какие величины можно
определить количество вещества?
Что такое молярная масса, с чем численно совпадает?
6. Определить:
масса 3 моль Н2О составляет __________
масса 20 моль СО2 равна __________
7. Что такое молярный объем?
Слайд 5
Количество вещества –
физическая величина, которая
Означает
определенное число
структурных элементов
(атомов,молекул,ионов)
Обозначается
Υ (ню)
Измеряется в международной системе единиц (СИ)
моль
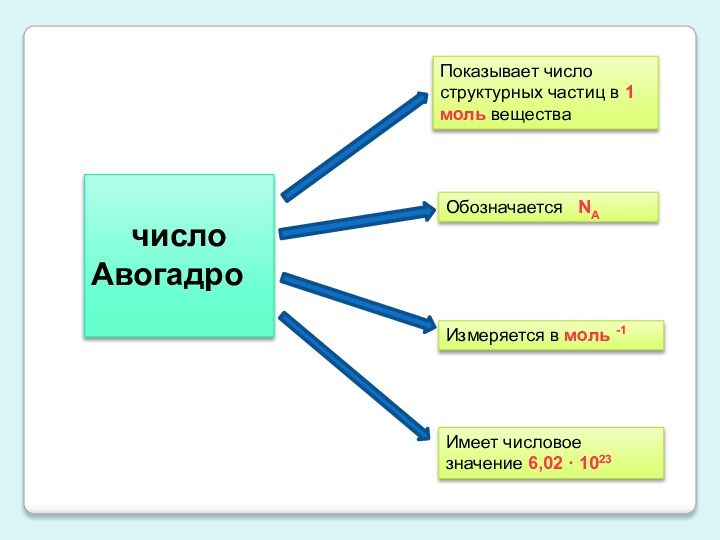
Слайд 6
число
Авогадро
Показывает число структурных частиц в 1 моль
вещества
Обозначается NА
Измеряется в моль -1
Имеет числовое значение 6,02
· 1023
Слайд 7
Молярная масса численно равна относительной молекулярной массе вещества
Молярная
масса – физическая величина, которая
Показывает массу в
1 моль
вещества
Обозначается М
Измеряется г\моль
М = m \ υ
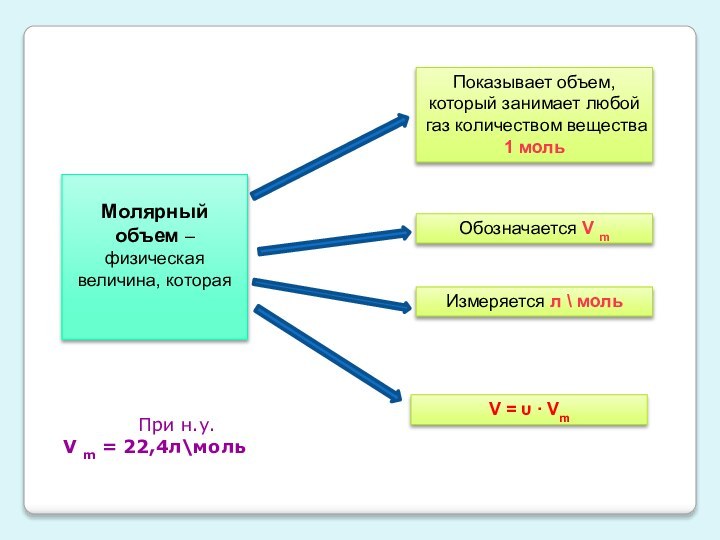
Слайд 8
Молярный объем – физическая величина, которая
Показывает объем, который
занимает любой газ количеством вещества 1 моль
Обозначается V m
Измеряется
л \ моль
V = υ ∙ Vm
При н.у.
V m = 22,4л\моль
Слайд 9
Теоретическое исследование
Задача № 1.
В двух резиновых шариках при
одинаковых условиях находятся газы: в одном гелий массой 1
грамм, в другом - водород количеством вещества 0,25 моль. Объем какого шарика больше? Ответ подтвердите расчетами.
Слайд 10
Задача № 2
На левой чашке рычажных весов лежит
порошок железа массой 11,2 грамма, на правой – такой
же порошок количеством вещества 0,2 моль. Определите положение весов.
А. Перетягивает левая чашка
Б. Перетягивает правая чашка
В. Весы в состоянии равновесия
Слайд 11
Практическое исследование
Задание № 1.
Каждый день мы употребляем сахар,
например, когда пьем чай. Но вы когда – нибудь
задумывались:
Сколько моль сахара содержится в кусочке рафинада.
Какое количество сахарозы вы выпиваете с чаем?
Слайд 12
Карта исследования по теме
«Количество вещества. Моль. Молярная
масса»
Оборудование: весы с разновесами, мерный цилиндр,
химический стакан, мерная ложка,
фильтровальная бумага.
Вещества: вода, сахар – рафинад.
Порядок выполнения работы:
Вспомните правила взвешивания (см. приложение 1)
В таблице расчетов запишите молекулярную формулу сахара, если известно, что в состав молекулы входят двенадцать атомов углерода, двадцать два атома водорода, одиннадцать атомов кислорода.
Подсчитайте ее молекулярную массу и результат запишите в таблицу.
На весах взвесьте кусочек рафинада, сделайте расчеты в таблице и определите, какое количество сахарозы вы выпиваете с чаем.
Слайд 14
Карта исследования по теме:
«Количество вещества. Моль. Молярный объем»
1.
В мерный цилиндр отмерьте 12 столовых ложек воды. Определите,
какое количество моль воды содержится в этом объеме.
2. Вспомните правила определения объема жидкости (см. приложение 2)
3. Подсчитайте количество молекул напитка, если известно, что в стакане 50 мл.
4. Сделайте вывод по работе.
Слайд 15
Задание № 2
Пока вы проводили расчеты, я вам
разлила в стаканчики минеральную воду объемом 50 мл. Вы
можете выпить ее и ответить на вопрос:
- Сколько молекул этого напитка вы сейчас проглотили?
- Что нужно для этого знать?
Слайд 16
Вывод
Зная массу вещества и объем, можно найти количество
вещества, а по количеству вещества можно определить m, N,
V, то есть, все эти величины взаимосвязаны.