- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Металлы химия 10 класс
Содержание
- 2. Что такое металлы ? Металлы – химические
- 3. Роль металлов в развитии цивилизацииВ древности человеку были известны только 7металлов:Золото(Au),Серебро(Ag),Медь(Cu),Олово(Sn), Свинец(Pb),Железо(Fe)Ртуть(Hg).
- 4. МедьУстановлено, что египтяне за несколько тысячелетий до
- 5. БронзаПервыми людьми, из древнего мира которые выплавили
- 6. ЖелезоПервое железо люди выплавляли из метеоритов, оно
- 7. Нахождение в природе
- 8. Закономерность изменения свойств металлов в группе.Заряд ядра
- 9. Закономерность изменения свойств металлов в периоде.Заряд ядра
- 10. Получение металловПирометаллургический способ -восстановление углеродом, оксидом углерода
- 13. Все металлы- твердые вещества, кроме ртути. Самый мягкий – калий.Самый твердый – хром.
- 14. Физические свойства металлов.Модели кристаллических решёток металлов: а) кубическая гранецентрированная; б) кубическая объёмноцентрированная; в) гексагональная
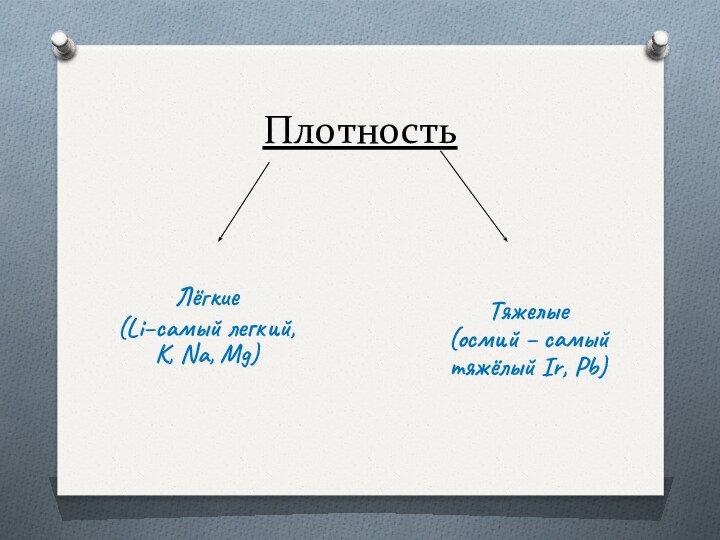
- 15. Плотность Лёгкие(Li–самый легкий, K, Na, Mg) Тяжелые(осмий – самыйтяжёлый Ir, Pb)
- 16. Температура плавления Легкоплавкие Hg, Ga, Cs, In, BiТугоплавкиеW, Mo, V, Cr
- 17. Взаимодействие с простыми веществами - С
- 18. Скачать презентацию
- 19. Похожие презентации
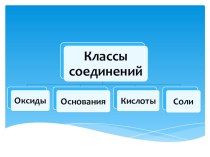
Что такое металлы ? Металлы – химические элементы, образующие в свободном состоянии простые вещества с металлической связью.
















Слайд 2
Что такое металлы ?
Металлы – химические элементы, образующие
в свободном состоянии простые вещества с металлической связью.
Слайд 3
Роль металлов в развитии цивилизации
В древности человеку были
известны только 7металлов:
Золото(Au),
Серебро(Ag),
Медь(Cu),
Олово(Sn),
Свинец(Pb),
Железо(Fe)
Ртуть(Hg).
Слайд 4
Медь
Установлено, что египтяне за несколько тысячелетий до нашей
эры уже умели изготавливать изделия из меди. Иногда в
очаг попадали небольшие самородки меди, которые размягчались в огне. Люди заметили, что раскаленный кусок меди меняет форму при ударе. Это свойство позволило выковывать из меди ножи, шилья и другие предметы. Затем люди научились выплавлять медь из руды. Расплавленную медь заливали в форму и получали медное изделие нужного вида.
Слайд 5
Бронза
Первыми людьми, из древнего мира которые выплавили бронзу,
были египтяне. Они создали прочный по тем временам сплав
– бронзу, смешав олово и медь. Это позволило усовершенствовать орудия труда и победить соседей, не обладавших бронзой.
Слайд 6
Железо
Первое железо люди выплавляли из метеоритов, оно было
очень дорогим. Даже победителям Олимпийских игр наряду с золотыми
медалями давали кусок железа. Железный клинок был обнаружен в гробнице Тутанхамона. Позднее люди научились выплавлять железо из руд, и оно стало массовым.
Слайд 8
Закономерность изменения свойств металлов в группе.
Заряд ядра увеличивается,
так как увеличивается порядковый номер.
R увеличивается, так как увеличивается
количество энергетических уровней.Число электронов на последнем уровне постоянно.
Способность к отдаче электронов увеличивается.
Восстановительные способности и металлические свойства увеличиваются.
Слайд 9
Закономерность изменения свойств металлов в периоде.
Заряд ядра увеличивается,
так как увеличивается порядковый номер.
R уменьшается, так как заряд
ядра больше, способность притягивать электроны возрастает, за счет этого происходит стягивание электронных оболочек.Число электронов на внешнем уровне увеличивается, так как растёт номер группы.
Восстановительные способности и неметаллические свойства уменьшаются.
Слайд 10
Получение металлов
Пирометаллургический способ -восстановление углеродом, оксидом углерода (II),
водородом при высокой температуре.
Алюминотермический способ – восстановление металлов с
помощью алюминия.Гидрометаллургический способ – получение из руды более активным металлом или из растворов
Электролиз – с помощью электрического тока из расплавов или растворов