- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Минеральные и органические соединения углерода
Содержание
- 2. Значение и функции соединений углерода в почвообразовании
- 3. В настоящее время известно более 4млн соединений
- 4. Причина уникального многообразия органических соединений заключается в
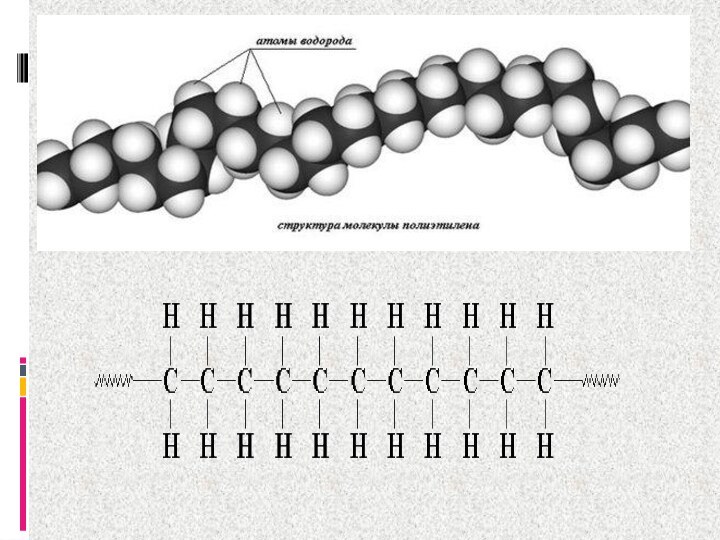
- 6. Углерод расположен в середине второго периода, атом
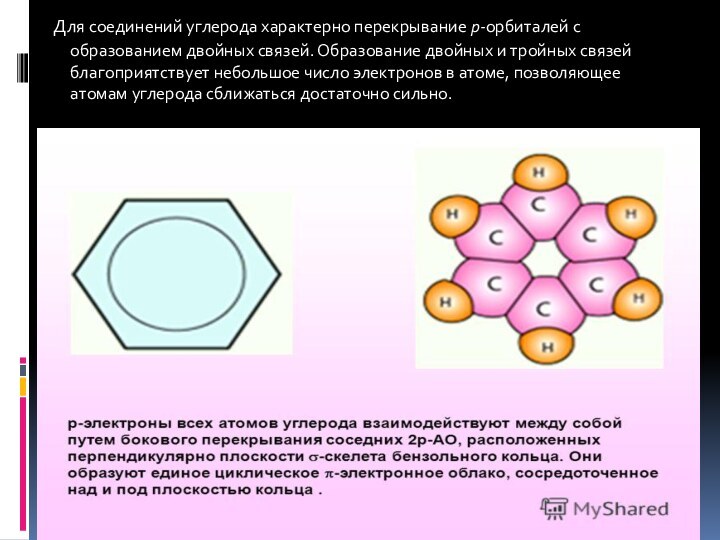
- 7. Для соединений углерода характерно перекрывание p-орбиталей
- 8. Важная особенность углерода состоит в его способности
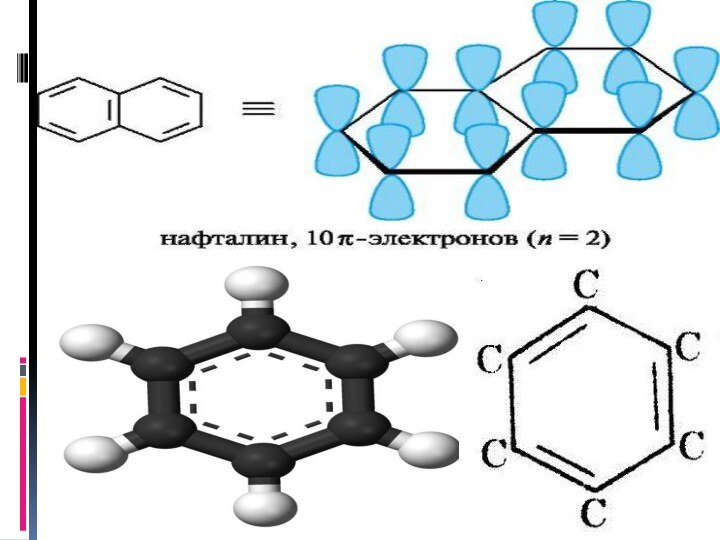
- 9. Одна из особенностей ароматических соединений по сравнению
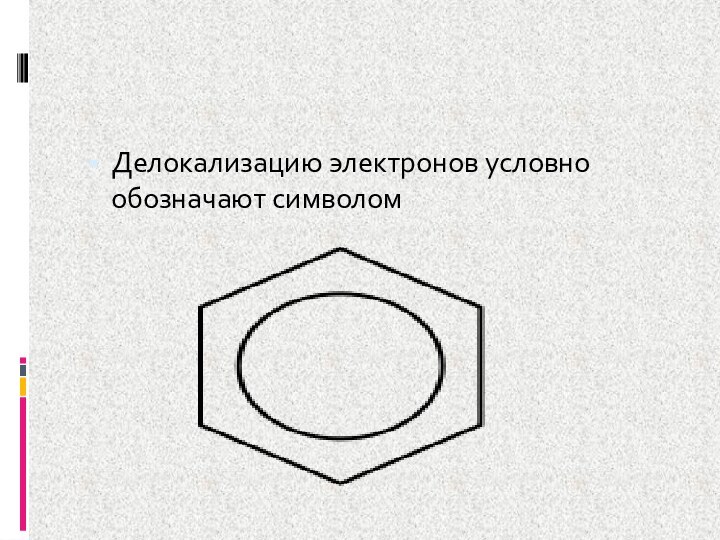
- 10. Делокализацию электронов условно обозначают символом
- 12. В состав органического вещества почв входят различные
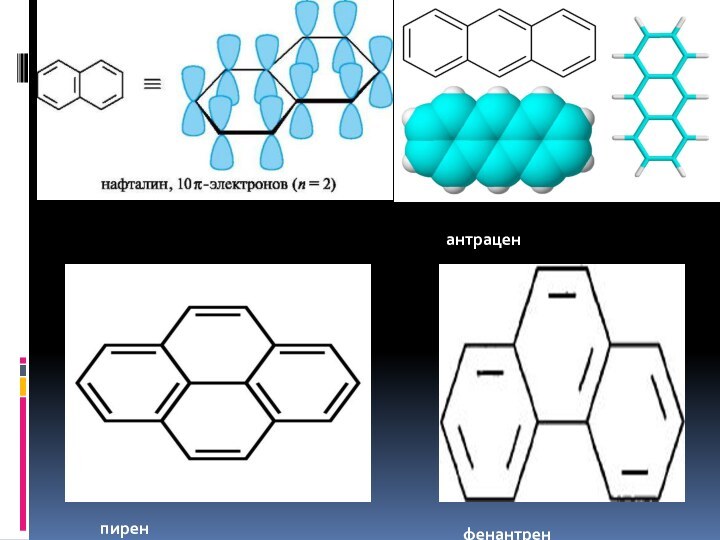
- 13. антраценфенантренпирен
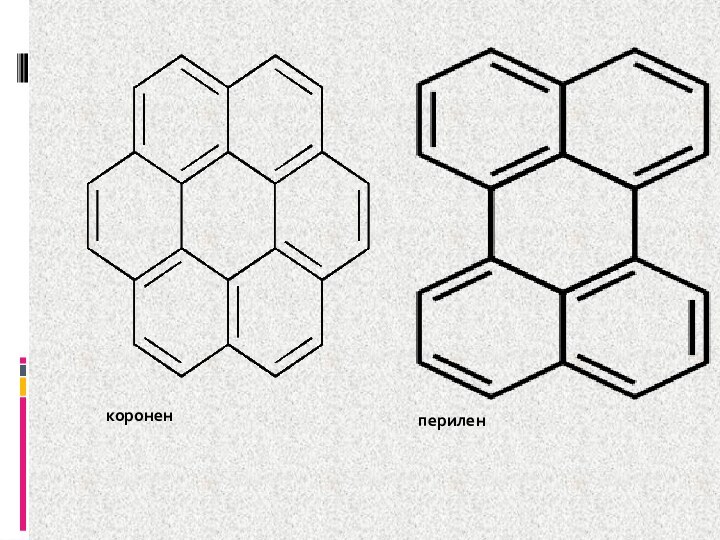
- 14. короненперилен
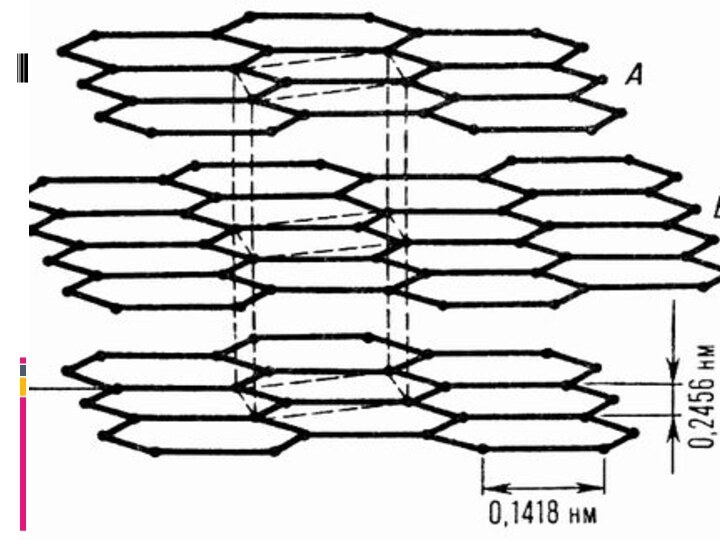
- 15. В качестве варианта конденсированной ароматической системы можно
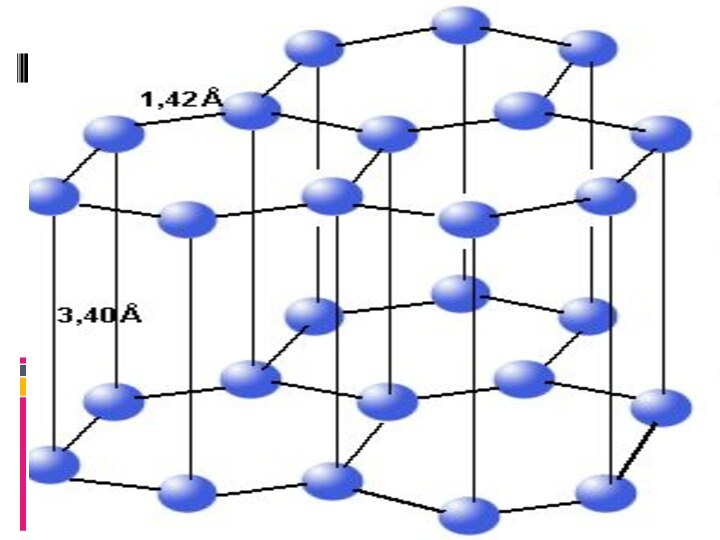
- 17. Плоскости, или слои гексагональных циклов, взаимно расположены
- 19. Таким образом положение слоев чередуется через 1
- 20. Химически графит мало активен и термодинамически устойчив
- 21. Хотя нагревание графита со смесью концентрированных НNO3
- 22. Промежуточным продуктом окисления является графитовые кислоты переменного
- 23. В почвах образуются и встречаются соединения углерода
- 24. Производные СО2- угольную кислоту и карбонаты –
- 25. Скачать презентацию
- 26. Похожие презентации
Значение и функции соединений углерода в почвообразовании определяются многообразием образуемых им соединений и их особой ролью в процессах жизнедеятельности.