- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Современное представление о строении атома. Готовимся к ЕГЭ и ОГЭ!
Содержание
- 2. Химия – наука о веществах, их свойствах и превращениях. Неорганическаяхимия ОрганическаяхимияПо признакам
- 3. Вещество – это форма существования материальных объектов,
- 4. Химические реакции – это процессы превращения одних
- 5. Состав вещества.Атом – наименьшая химическая частица вещества.При
- 6. Схема строения атома (по Бору- Резерфорду) Любой
- 7. Определённый вид атомов называется химическим элементом.Каждый химический
- 8. Электронная оболочка атома.Электронная оболочка любого атома делится
- 9. Формы атомных орбиталей. Формы s–орбитали и трёх p–орбиталей представлены на схеме; d,f-орбитали имеют сложные объёмные конфигурации.
- 10. Заполнение атомных орбиталей электронами происходит в соответствии
- 11. Принцип максимальной мультиплетности (правило Хунда):в пределах подуровня
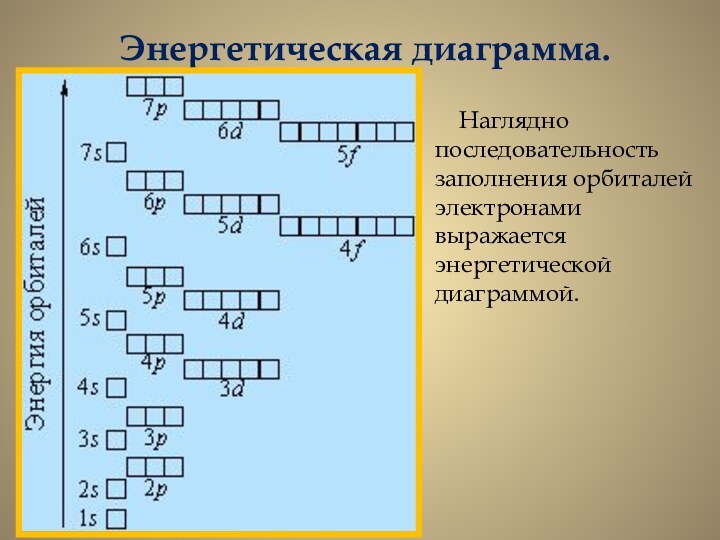
- 12. Энергетическая диаграмма. Наглядно последовательность заполнения орбиталей электронами выражается энергетической диаграммой.
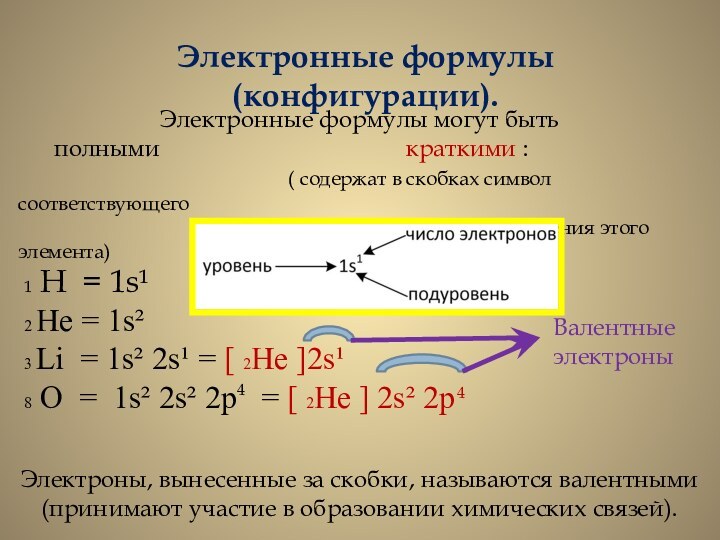
- 13. Электронные формулы (конфигурации).Электронные формулы могут быть
- 14. Для свободных атомов подгрупп II
- 15. Атомы типичных металлов легко отдают
- 16. Проверь себя!Задание № 1.Составьте полные электронные формулы:а)
- 17. Ответы тест (задание № 3):б)г)а) 20; б) 28; в) 18
- 18. Скачать презентацию
- 19. Похожие презентации


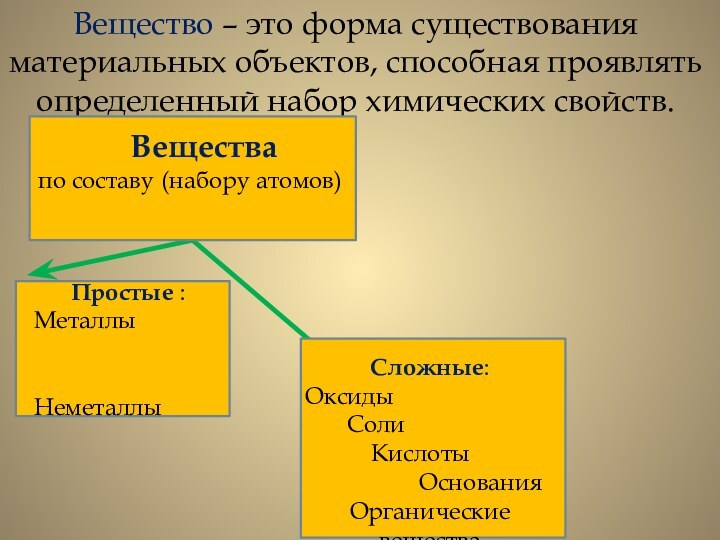













Слайд 3 Вещество – это форма существования материальных объектов, способная
проявлять определенный набор химических свойств.
Простые :
Металлы
Неметаллы
Сложные:
Оксиды
Соли
Кислоты
Основания
Органические вещества
Вещества
по составу (набору атомов)
Слайд 4 Химические реакции – это процессы превращения одних веществ
в другие.
Химические свойства веществ не зависят от агрегатного состояния.
Слайд 5
Состав вещества.
Атом – наименьшая химическая частица вещества.
При разрушении
атом распадается на более мелкие физические частицы:
ē – электрон;р - протон;
n ° - нейтрон;
число этих частиц у разных
атомов различное.
+
Слайд 6
Схема строения атома (по Бору- Резерфорду)
Любой атом
– электронейтральная частица.
Ядро (заряжено положительно) включает некоторое количество протонов
и нейтронов.Электронная оболочка (заряжена отрицательно) включает в себя некоторое число электронов , обязательно равное числу
протонов в ядре.
Атом водорода
Слайд 7
Определённый вид атомов называется химическим элементом.
Каждый химический элемент
имеет свое название и свой символ.
Все атомы одного элемента
имеют равное число протонов в ядре и электронов в оболочке.Атому одного элемента могут различаться числом нейтронов в ядре – изотопы.
Элемент водород имеет 3 изотопа:
водород – 1( протий ¹Н);
водород – 2 ( дейтерий ²Н, или D);
водород – 3 ( тритий ³Н, или Т).
Химический элемент.
³Н верхний индекс - массовое число
(сумма протонов и нейтронов в ядре).
Слайд 8
Электронная оболочка атома.
Электронная оболочка любого атома делится на
энергетические уровни.
Энергетические уровни делятся на подуровни.
Подуровни состоят из атомных
орбиталей.Атомные орбитали энергетические подуровни
(1s ,2s, 2p, 3s, 3p, 3d…) (s,p,d,f)
Энергетические уровни (1,2,3-й и т.д.)
Слайд 9
Формы атомных орбиталей.
Формы s–орбитали и трёх p–орбиталей
представлены на схеме;
d,f-орбитали имеют сложные объёмные конфигурации.
Слайд 10 Заполнение атомных орбиталей электронами происходит в соответствии с
тремя условиями:
Принцип минимума энергии: ē заполняют орбитали, начиная с
подуровня с меньшей энергией.Правило запрета (принцип Паули): в каждой орбитали может разместиться не более двух ē .
Пустая орбиталь Орбиталь с Орбиталь с
неспаренными ē электронной парой
Слайд 11 Принцип максимальной мультиплетности (правило Хунда):в пределах подуровня электроны
сначала заполняют все орбитали наполовину, а затем – полностью.
Каждый ē имеет свою собственную характеристику – спин (условно изображается стрелкой ). Спины ē складываются в вектора, сумма спинов данного числа ē на подуровне должна быть максимальной (мультиплетность)
Слайд 12
Энергетическая диаграмма.
Наглядно последовательность заполнения орбиталей
электронами выражается энергетической диаграммой.
Слайд 13
Электронные формулы (конфигурации).
Электронные формулы могут быть
полными
краткими :( содержат в скобках символ соответствующего
благородного газа + накопления этого элемента)
1 Н = 1s¹
2 He = 1s²
3 Li = 1s² 2s¹ = [ 2He ]2s¹
8 O = 1s² 2s² 2p = [ 2He ] 2s² 2p
4
4
Электроны, вынесенные за скобки, называются валентными (принимают участие в образовании химических связей).
Валентные
электроны
Слайд 14 Для свободных атомов подгрупп II –
IV групп Периодической системы обычное состояние валентных электронов называется
основным. Для этих же атомов возможно возбуждённое состояние:Атом
Состояние
основное
возбуждённое
Mg
Al
Si
s p
s p
s p
Слайд 15 Атомы типичных металлов легко отдают свои
валентные электроны (полностью или частично) и становятся простыми катионами
:К (4s¹) K (4s°)
Атомы типичных неметаллов легко принимают дополнительные электроны на валентные подуровни (до 8 внешних ē и становятся простыми анионами:
N (2s² 2p³) N³¯ (2s²2p³+³)
+
Слайд 16
Проверь себя!
Задание № 1.Составьте полные электронные формулы:
а) для
катионов Li+; Mg²+; Al³+;б) для анионов N ³¯; Cl
¯; S ²¯.Задание № 2. Установите, возможно ли (да, нет) с точки зрения строения атомов образование ионов: а) О³¯; б) О²¯.
Задание № 3 тест (5 – 7 мин.)
Четырехэлементарное вещество:
а) нитрат аммония; б) гидроортофосфат магния; в) фруктоза;
г) хлорбензол.
Название элемента с электронной формулой атома [Ar]3d²4s² - это а) селен; б) алюминий; в) цинк; г) титан.
Укажите общее число электронов в частицах а) Ве²+, Cl¯ ; б) Na+, S²¯; в) Н+, Р³¯





























